В последнее время в мире обострились проблемы топливной энергетики: в связи быстрым ростом экономик мира увеличилось потребления топлива, что в свою очередь сказывается на экологии: загрязнение воздуха, воды, почв.
Одним из перспективных направлений получений новых видов энергии является водородная энергетика [2] (получения водорода и использования его в качестве топлива в различных устройствах и технологических процессах) , имеющая свои явные плюсы:
1. Доступность сырья (получение водорода возможно из различных веществ, минералов- уголь, вода, электролиты );
2. При сжигании водорода образуется значительно меньше вредных веществ
3. Высокая энергоёмкость водорода, за счет чего его можно использовать в существующих авиационных, автомобильных двигателях без существенных переделок
4. Использование в различных областях (химия, пищевая промышленность. металлургия), где потребность в водороде только возрастает.
Однако массовое использование водорода как топливо сдерживается следующими факторами:
- Взрывоопасность (образует с воздухом взрывоопасные смеси)
- Низкая температура сжижения (возникают трудности по хранению и его транспортировки)
- Трудности при хранении (высокая проникаемость молекул водорода).
- Высокая энергоёмкость при получении водорода в промышленных масштабах
Одним из перспективных направлений получения водорода является электролиз воды. Использование данного способа получения водорода совместно с традиционным двигателем (внутреннего сгорания) (по аналогии с применением газо-бензиновых систем в двигателях внутреннего сгорания [4]) даст следующие преимущества:
- Повышение экологичности двигателя (снижение выбросов в окружающую среду)
- Экономия топлива (за счет высокой энергоёмкости водорода)
- Повышение КПД двигателя
- Универсализация и минютиаризация установки для получения водорода
Цель данной работы: исследование процесса электролиза и конструирование универсальной установки для получения и использования водорода.
Задачи работы:
1) Изучение процессов электролиза воды в водных растворах при различных параметрах процесса (при различных электродах и электродных схемах, напряжениях, электролитах);
2) Анализ и обработка полученной экспериментальной информации, выделение существенных факторов влияющих на процесс
3) Разработка безопасных компактных топливных устройств на основе генератора водорода.
Цель - изучение процесса электролиза для дальнейшей оптимизации процесса получения водорода исходя из условий низкого энергопотребления максимального получения объёма водорода и минимизации конструкций.
Электролизом называется совокупность процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита[3].
Электрод, на котором происходит восстановление, называется катодом, а электрод, на котором происходит окисление, называется анодом.
При подаче электрического тока на электроды на границе металл-раствор могут происходить следующие явления: прежде всего это – образование двойного электрического слоя, окисление или восстановление металла электрода в зависимости от, того чем является электрод: катодом или анодом, образование оксидной пленки, восстановление водорода (на аноде) и кислорода на (катоде).
В данном случае исследования проводятся с использованием титановых (анод) и стальных (катод) электродов.
При соприкосновении двух электропроводящих фаз между ними возникает разность электрических потенциалов, что связано с образованием двойного электрического слоя (рис. 1), т.е. несимметричного распределения заряженных частиц у границы раздела фаз. Причинами возникновения скачка потенциала между двумя фазами являются, например, адсорбция молекул воды на металле.
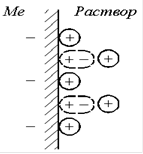
Рис. 1 Двойной электрический слой
По Гельмогольцу (1879), двойной электрический слой можно уподобить плоскому конденсатору, одна из обкладок которого совпадает с плоскостью, проходящей через поверхностные заряды в металле, а другие — с плоскостью, соединяющей центры тяжести зарядов ионов, находящихся в растворе, но притянутых электростатическими силами к поверхности металла.
Пассивация (образование окисного слоя) активного титана, объясняемая первоначальным возникновением окисла TiO, в принципе возможна при очень низком анодном потенциале (φ0= -1,3 В). 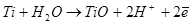
При повышении потенциала анод покрывается слоем окислов непостоянного состава, стандартный потенциал (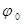 = - 0,86 В) соответствует реакции образования высшего окисла.
= - 0,86 В) соответствует реакции образования высшего окисла.
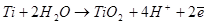
В стационарном состоянии невозможен слой, состоящий только из низших окислов. В слое есть полный набор окислов, но расстояние, на котором завершается изменение состава, уменьшается с ростом напряжения на слое. Следует различать толстый слой, на внутренней стороне, которого расположены низшие окислы (TiO), а на внешней (у раствора) - высшие окислы (TiO2). Внешняя часть слоя может быть однородной по составу и содержать только высшие окислы. Развитие окисного слоя происходит следующим образом (рис 2).
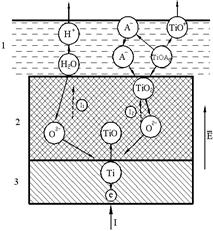
Рис. 2 Окисный слой титанового электрода
1. На границе слоя с раствором может протекать реакция разложения воды на границе между раствором 1 и внешней поверхностью окисного слоя 2. 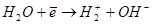 в результате чего в раствор переходят ионы водорода H+, а вглубь под действием электрического поля движутся ионы кислорода O2-;
в результате чего в раствор переходят ионы водорода H+, а вглубь под действием электрического поля движутся ионы кислорода O2-;
2. Частичное (или полное) вытеснение анионами электролита A- кислорода из окислов на внешней границе окисного слоя, в итоге, в раствор переходят растворимые соединения (например, TiOA2), диссоциирующие на катионы (TiO+) и анионы (A-), а ионы кислорода O2- движутся вглубь под действием поля;
3. Миграция ионов кислорода О2- в поле 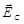 к границе между слоем 2 и металлом 3, окисление (или до окисление) титана ионами кислорода на внутренней границе слоя (или в самом слое); перенос заряда электронами
к границе между слоем 2 и металлом 3, окисление (или до окисление) титана ионами кислорода на внутренней границе слоя (или в самом слое); перенос заряда электронами 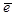 , освобожденными после реакции окисления или до окисления титана ионами кислорода.
, освобожденными после реакции окисления или до окисления титана ионами кислорода.
Анодное растворение титана в условиях электролиза (происходит через промежуточную стадию образования окислов). Согласно экспериментальным данным растворение начинается примерно при 10 В.
ЭКСПЕРИМЕНТАЛЬНАЯ УСТАНОВКА И ПРОВЕДЕНИЕ ОПЫТОВ
Гидролизер мокрого типа устроен следующим образом.
В герметичном отсеке находятся три электрода, находящиеся друг от друга на расстояние 2 миллиметра. Электрод из нержавеющей стали является анодом, титановый электрод – катод, посередине расположен биполярный титановый электрод (такой тип электродов не нуждается в механическом соединении с источником питания).
Гидрозатвор – небольшая емкость на три четвертых заполненная водой. В крышки присутствует два штуцера, на вход и выход газа. Входной штуцер обладает трубкой доводчиком газа до дна.
Все эксперименты проводились при температуре воздуха 26 градусов по Цельсию. Электролит - дистиллированная вода с добавлением NaCO? (пищевая сода), в размере 16 грамм на 100 миллилитров, объём заливаемого электролита 400 миллитров. На электроды подавалось постоянное напряжение 12В, в зависимости от порядка расстановки электродов менялась сила тока.
Цель эксперимента - достижение максимальной силы тока при генерации газа и минимальному нагреву проводов питания электродов. Чем больше сила тока, тем больше генерируется газа. В результате экспериментов был, достигнут наилучший показатель силы тока в 2,5 ампера. Расчет выделившегося водорода производился закону электролиза фарадея 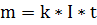 Где m- масса водорода, г; k= 0,0376 г/(А*час)- электрохимический эквивалент; I- сила тока через электролит, А: t- время протекания тока, час. Расчет по формуле дал следующие результаты: масса выделившегося водорода за 10 минут проведения процесса при токе 2.5 А составила 0.0157 г. С учётом того что плотность водорода (при температуре окружающего воздуха 25°С) составляет 0.082 кг/м3 объём выделившегося водорода составил 0.194 л.
Где m- масса водорода, г; k= 0,0376 г/(А*час)- электрохимический эквивалент; I- сила тока через электролит, А: t- время протекания тока, час. Расчет по формуле дал следующие результаты: масса выделившегося водорода за 10 минут проведения процесса при токе 2.5 А составила 0.0157 г. С учётом того что плотность водорода (при температуре окружающего воздуха 25°С) составляет 0.082 кг/м3 объём выделившегося водорода составил 0.194 л.
На основе принципиальной схемы была разработана и собрана конструкция установки для получения водорода и использования его в качестве топлива для горелки (рис3)
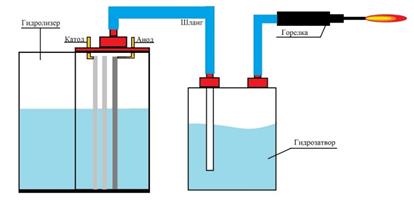
Рис.3 Схема установки получения водорода для использования в горелке
Нами был разработано несколько вариантов таких топливных элементов.

На первой версии устройства отрабатывалась технология сборки, и режимы работы установки. Система использовалась для водородной горелки. Недостатки данного устройства:
1. Низкая производительность при разложении воды.
2. Проблемы с герметичностью установки.
3. Громоздкость установки

Данные недостатки были устранены в следующей версии устройства.
При создании использовались следующие материалы: оргстекло, резина, нержавеющая сталь. Данный гидролизер питается от аккумуляторов 18650 что делает конструкцию компактной.
Несмотря на простоту схемы получения водорода из воды и изученность процесса электролиза определились следующие направления работы по оптимизации процесса электролиза и снижения массогабаритных характеристик установки получения водорода:
1. Исследования по использованию электродов из других материалов: сталь, жесть, алюминий, медь в различных сочетаниях.
2. Исследования по использованию электродов различных форм: выпуклые, шаровые, перфорированные и игольчатые.
3. Использование различных типов напряжения питания на электродах: постоянное, переменное, импульсное.
ВЫВОДЫ
1) В результате изучения процессов электролиза воды в водных растворах при различных параметрах процесса было выявлено, что сила тока напрямую влияет на количество генерируемого газа.
2) Анализ и обработка полученной экспериментальной информации показали, что вовремя процесса гидролиза происходит нагрев электролита и разрушения электрода, подключенного к аноду. Из 0.5 л водного раствора соли за 10 минут выделяется 0.191 л водорода.
3) Благодаря данному устройству можно разработать конструкции установок для резки металлов, повышение КПД двигателей и более экономного расходования бензина либо полного перехода на водородное топливо.
Библиографическая ссылка
Причина А.С. РАЗРАБОТКА КОМПАКТНОГО ТОПЛИВНОГО УСТРОЙСТВА // Международный школьный научный вестник. – 2020. – № 2. ;URL: https://school-herald.ru/ru/article/view?id=1310 (дата обращения: 19.04.2024).
