Введение
Влияние концентрации кислорода на клеточном уровне
Кислород необходим всем аэробным организмам. Значение кислорода в жизненном цикле организмов сложно переоценить, но слишком большое количество этого элемента становится главный фактором образования токсичных для организма веществ. Образуются активные формы кислорода: атомарный кислород, пероксид водорода, пероксиды липидов (одно из проявлений пагубных воздействий пероксидов липидов является взаимодействие свободных радикалов с ненасыщенными жирными кислотами мембран, нарушая их структуру), пероксильные радикалы (протонированная форма супероксида с формулой HO2•), оксид азота, гипохлорид (НОСl). Эти вещества являются сильными окислителя биологических жидкостей и может повреждать ткани в результате реакции с липидами, белками, ДНК, аминокислотами и некоторыми другими молекулами. [1]
АФК постоянно образуются как нормальные продукты метаболизма кислорода. Нормальные функции АФК включают активацию иммунной системы и мобилизацию системионного транспорта. Например, клетки крови на месте повреждения начинают продуцировать АФК, что рекрутирует тромбоциты, необходимые для начала процесса заживления раны. АФК также запускают программируемую клеточную смерть (апоптоз). Но высокая концентрация АФК в клетке может способствовать не программированной смерти клетки.
Образование активных форм кислорода в клетке
Молекулярный кислород (O2) имеет два неспаренных электрона на отдельных орбиталях во внешней электронной оболочке. Эта химическая структура усиливает генерацию АФК.
В целом, основными эндогенными источниками АФК у человека и, в частности, у новорожденного являются метаболизм митохондрий, повышенное содержание переходных металлов в свободном обращении, воспаление через реакции НАДФН-оксидазы, гипоксия-реоксигенация, гипероксия, и парадоксальным образом, гипоксия.
АФК в клетке образуются в процессе окислительно-восстановительных реакций. Одними из главных генераторов являются пероксисомы, образуя пероксид водорода. Н2О2 является самым стабильным соединением из возможных восстановленных форм кислорода и менее реакционно способным, по сравнению с другими. Он играет сигнальную функцию, а при присутствии активаторов из пероксида образуется гидроксильный радикал. Гидроксильный радикал обладает высокой реакционной способностью и может разрушить практически все клеточные структуры, но он имеет очень короткое время жизни и не способен диффундировать на значительные расстояния.[2]
Так же АФК образуется в лизосомах, микросомах, эндоплазматическом ретикулуме, цитозоле, протеосомах, а также цитоплазматической мембране.
Дыхательная цепь митохондрий служит основным источником активных форм, в которых потребляемый кислород восстанавливается до воды в процессе окислительного фосфорилирования кислорода.
В большинстве случаев образование АФК связано с метаболическими путями в клетках, такими как окисление жирных кислот и углеводов, окислительной конформации белков. При этом образование АФК находится под строгим метаболическим контролем, который включает компартментализацию окислительных реакций.
Роль АФК в патологии клетки
Активные формы кислорода могут как обратимо, так и не обратимо окислять или восстанавливать биологические молекулы, но легче всего взаимодействуют с молекулами, в состав которых входят атомы с переменной валентностью (сера, железо и т.д.). Например, в метаболизме железа, который очень важен для правильного неврологического развития и роста, образуется токсичный OH • . При большой концентрации железа в организме трансферрин плазмы становиться перегруженным и свободные формы железа вступают в реакции с восстановленным кислородом, происходит реакция Фентона-Гарбера Вейсса:

Основные виды повреждения биомолекул гидроксильным радикалом:
· отрыв атома водорода (таким образом повреждается лецитин — компонент биологических мембран, а также сахара в составе нуклеозидов ДНК)
· присоединение к молекулам по двойным связям (взаимодействие с пуринами и пиримидинами ДНК и РНК, перенос электронов также является важным в повреждающем действии ОН)
Прямое повреждение ДНК при этом характеризуется разрывом цепи, окислением оснований, их модификации, образованием гидропероксидов ДНК, повреждением хромосом. С белками ОН образует гидропероксиды, что может изменить третичную структуру белков и даже вызывать их агрегацию и денатурацию. Это приводит к нарушению ферментативной и регуляторной активности многих процессов. С липидами ОН образует перекисные соединения.
Митохондрии более всех других органелл подвержены атаке АФК и, как следствие, повреждению мембранных липидов, белков, ДНК и даже гибели. Причем для гибели митохондриям не требуется никаких дополнительных белков, кроме тех, которые присутствуют в них самих. АФК служат элементом отрицательной обратной связи, блокируя ферменты цикла Кребса и осуществляя переход с аэробного на анаэробный гликолиз, а также обеспечивая соответствие энергетического метаболизма потребности и возможности клетки.
Митохондрии обладают мощной антиоксдантной системой для защиты от пагубных влияний АФК. Она включает в себя ферменты супероксиддисмутазу, пероксидазу и глутатионпероксидазу (деградация перекиси водорода), а также глутатион, восстановленную форму коэнзима Q, аскорбиновую кислоту и другие низкомолекулярные антиоксиданты. Если защитная система не справляется, то в клетке развивается окислительный стресс. АФК перестают выполнять сигнальные функции и проявляют деструктивные. Начинается разрушение липидов, белков и практически всех клеточных структур. Наблюдается разрушение митохондриальных структур от мембраны до митохондриальных ДНК (мтДНК).
Окислительный стресс является причиной множества дегенеративных заболеваний (болезнь Альцгеймера, появление онкологических заболеваний, и т.д.), старения и гибели клетки. Активные формы кислорода, образующиеся в митохондриях, рассматриваются в качестве основного фактора развития внутриклеточного окислительного стресса под воздействием гипоксии, ишемии и реперфузии.
Гипоксия и гипероксия у недоношенных и влияние АФК на развитие ребенка
В течение родов ребенок из относительной гипоксии попадает в относительную гипероксию, а высокая концентрация кислорода после гипоксии вызывает окислительный стресс. Так как у новорожденных повышен риск к оксидативному стрессу (из-за недостатка анти- и прооксидантов таких как: глутатионпероксидазы, аскорбиновая кислота, рибофлавин, суперооксидимудазы и т.д.), терапия новорожденных в первую неделю после рождения (ИВЛ, оксигенотерапия, парентеральное кормление) усугубляет оксидативный стресс.
Уровень и активность наиболее важных антиоксидантных ферментов динамически изменяются в процессе развития и созревают в последние недели беременности, подготавливая плод к дыханию легким. Следовательно, недоношенные младенцы особенно подвержены окислительному стрессу поскольку они не готовы к относительной гипероксии во внематочной жизни. Показано, что 30-минутное воздействие 100% О2 при рождении может вызвать значительное увеличение перекисного окисление липидов у новорожденных овец.
В клинических условиях было признано, что генерация АФК после гипероксии ответственна за повреждения легких, центральной нервной системы, сетчатки и эритроцитов, а также за общее повреждение тканей, о котором можно сообщать как в неонатальном периоде, так и во взрослой жизни.
Сосредоточившись на неонатальном периоде, следующие параграфы объясняют механизмы как краткосрочных, так и долгосрочных токсических эффектов введения кислорода и гипероксии на различные органы и системы организма.
Развитие легких недоношенных при гипероксии
Респираторные нарушения занимают ведущее место в структуре патологии недоношенных детей. Дыхательная недостаточность, возникшая в раннем неонатальном периоде у недоношенного ребенка, является наиболее частой причиной смертности новорожденного и формирования хронической патологии дыхательной системы в последующем.
Гипероксия и генерация АФК крайне вреден для легких. Токсические радикалы кислорода запускают реакции, которые приводят к развитию воспалительного процесса в легких, к инактивации сурфактанта и антипротеаз, нарушению проницаемости альвеолярно-капилярной мембраны, усилению притока в интерстиций нейтрофилов и макрофагов, выходу из сосудов больших количеств провоспалительных цитокинов и медиаторов воспаления.
Доклинические исследования
Моделирование кислородного повреждения легких на животных помогает в исследовании и лечении данных повреждений на людях. North et al. показали, что 100% концентрация кислорода вызывает у мышей фетотипически похожее на бронхолегочную дисплазию (БЛД) заболевание. Так же было обнаружен, что новорожденные мыши могли жить при максимальной концентрации кислорода в течение недели, тогда как взрослые особи умирали в течение нескольких дней. Еще одно исследование, которое доказывает, что кислород тоже вызывает у животных БЛД было проведено Делемосом Р.А и др. Они сообщили, что недоношенные павианы имели наименьшее повреждение легких при оптимальном системном артериальном давлении (<30% после 3-го дня жизни). Но когда павианы подвергались 100% концентрации кислорода в течение тех же 11 дней развивались тяжелые повреждения легких (интерстициальная эмфизема легких, кровоизлияние, псевдокисты) и анатомию БЛД. Поскольку обе группы вентилировались одинаково, воздействие кислорода было основной причиной повреждения легких у этих недоношенных приматов. Других недоношенных бабуинов вентилировали только с помощью дополнительного кислорода, достаточного для поддержания PaO2.в течение 21 дня, в то время как группа сравнения получала 100% кислород в течение 7 дней и 80% кислорода в течение еще 14 дней.Легкие животных были исследованы примерно через 8 месяцев, и высокое воздействие кислорода привело к увеличению альвеол и уменьшению числа альвеол.Были минимальные отклонения от нормы в легких с низким содержанием кислорода, но вентилируемых.Через несколько месяцев повышенное воздействие кислорода и острое повреждение легких прогрессировали до стойкой потери альвеол.
Клинические исследование развития недоношенных при гипероксии
Существуют клинические опыты, подтверждающие концепцию о том, что хроническое высокое насыщение кислородом может неблагоприятно влиять на состояние легких и глаз у недоношенных детей. Tin et al. сравнили стратегии одновременного лечения на севере Англии, которые нацелены на более высокое насыщение на 88–98% с более низкими целевыми показателями 70–90%. Младенцы, подвергшиеся воздействию более низких целевых показателей, нуждались в меньшей механической вентиляции, более коротком периоде дополнительного кислорода и имели меньше ретинопатию (РН). Chow et al.оценили, изменит ли изменение в практике ухода от процедур, минимально ориентированных на насыщение кислородом, к строгому ведению, чтобы избежать насыщения> 93–95% частоту РН. При строгом контроле O2насыщения, частота РН и потребность в лазерной терапии резко снизились во всех категориях веса при рождении.Подобный опыт изменения практики отделения интенсивной терапии новорожденных с минимального акцента на насыщении на строгое целевое значение насыщения до 85–93% привел к снижению РН и БЛД.[4]
Эти отчеты в совокупности предоставляют информацию о том, что у недоношенных детей можно лечить с насыщением <95% и что связанные с оксидантами неблагоприятные исходы, такие как БЛД и РН, могут быть уменьшены.Таким образом, недоношенные дети должны быть чувствительны к хроническому воздействию избыточного кислорода даже в пределах диапазона, который обычно считается терапевтическим.Эти клинические результаты являются результатом гораздо менее экстремального воздействия кислорода, чем те, которые использовались для моделей на животных.
Развитие БЛД и других повреждений легких
Хроническая кислородная токсичность может повредить эпителий легких, вызвать внутреальвеолярный отек, утолщение интерстициальной ткани (межкеточное пространство), последующий фиброз (разрастание соединительной ткани с появлением рубцовых изменений в различных органах) и ателектазу (спадение такни) легких. Данные повреждения связаны с производством АФК в ответ на гипероксию и последующий окислительный стресс.[3]
Проводилось исследование, которое показало, что у мышей, которые подвергались гипероксии в неонатальном периоде наиболее воспалены легкие и подвержены респираторным вирусным заболеваниям во взрослом возрасте. Так же у этих мышей наблюдались долговременные сердечные аномалии и нарушения нервной системы.
Одним из главных факторов, определяющих развитие БЛД, являются повышенная концентрация кислорода во вдыхаемом воздухе и воздействие ИВЛ на незрелую легочную ткань. В результате, избыток активных форм кислорода в сочетании с недостаточностью системы антиоксидантной защиты приводит к дисбалансу в системе «оксиданты-антиоксиданты» и развитию оксидативного стресса. При БЛД сохраняется хроническое воспаление на системном и местном уровне (легочная ткань), что подтверждается показателями ряда маркеров при данном заболевании. Отмечается повышение продукции эластазы в крови, разрушающей эластин альвеолярной стенки, что приводит к нарушению формирования и роста легкого, гиперреактивности бронхов и легочных сосудов.
Все изменения, происходящие в дыхательной системе у недоношенных детей, реагирует иммунная система. Однако, в связи с наличием дефицита гуморальных факторов защиты, факторов неспецифической резистентности и часто инфекционных заболеваний у недоношенного ребенка усугубляется иммунодефицитное состояние. В итоге у незрелого ребенка сохранятся длительное хроническое воспаление.
Развитие центральной нервной системы в условиях гипероксии
Мозг расходует около 20 % от общего потребляемого организмом кислорода: это уходит на поддержку нейронов и их коннектома, включающего в себя синапсы, что в свою очередь обслуживается глиальными клетками.
Избыток кислорода в окружающей среде влияет на процессы гликолиза и окисления в тканях мозга. В условиях гипероксии процессы окислительного фосфорилирования заметно нарушаются.
Одним из пусковых механизмов кислородной интоксикации при гипероксии может быть стимуляция свободнорадикальных процессов и перекисного окисления липидных мембран в результате высокого напряжения кислородов в ткани мозга.
В многочисленных исследованиях, проведенных на клеточный культурах, показано, что повышенная концентрация О2 сопровождается снижением внутриклеточного содержания полиаминов, а это в свою очередь приводит к подавлению репликации ДНК.
У новорожденных крысят гипероксия угнетала пролиферацию нервных клеток. В другом исследовании установлены значительные изменения ультраструктуры нейронов коры больших полушарий и среднего мозга при гипероксии, проявляющиеся в набухании митохондрий, снижение числа и дезориентация крист, исчезновение лизосом. По ходу воздействия кислорода также замечено изменение субстратной специфичности фермента и выхода его в цитоплазму.
Наблюдалось незначительное увеличение кровотока, вызванное активацией различных частей мозга. После вдыхания чистого кислорода активировались три структуры мозга: гиппокамп, который помогает контролировать артериальное давление; гипоталамус, который регулирует частоту сердечных сокращений; гормональный уровень. Активация гипоталамуса вызвала каскад вредных реакций и выпустила химические вещества, которые могут повредить мозг. Избыток кислорода вызывает увеличение количества окисленного гемоглобина в крови и снижение количества восстановленного гемоглобина. И, поскольку именно восстановленный гемоглобин выводит углекислый газ, его задержка в тканях приводит к гиперкапнии – отравлению CO2.
Полученные данные свидетельствуют о нарушении структуры и проницаемости мембран при острой гипероксии.
VEGF как индикатор гипоксии
Фактор роста эндотелия сосудов — сигнальный белок, вырабатываемый клетками для стимулирования васкулогенеза (образование эмбриональной сосудистой системы) и ангиогенеза (рост новых сосудов в уже существующей сосудистой системе). В семействе VEGF есть несколько видов белков: VEGF-A VEGF-B,VEGF-C,VEGF-D
VEGF А играет ведущую роль в регуляции ангиогенеза. Синтез этого фактора активируется в условиях гипоксии, а также за счет усиления транскрипции гена. При длительно существующей ишемии происходит накопление как самого фактора, так и мРНК, что доказывает положительную обратную связь между ишемией и синтезом VEGF.
VEGF стимулирует пролиферацию (разрастание ткани организма путём размножения клеток делением) клеток эндотелия сосудов, изолированных из артерий, вен и лимфатических сосудов in vitro [5]. На многих моделях показано активирующее действие VEGF на ангиогенез in vivo [6]. VEGF-A жизненно необходим для развития организма в эмбриональном и раннем постнатальном периодах. Инактивация одного аллеля VEGF-A приводит к гибели эмбриона при сроке 11–12 дней [7]. Введение мышам ингибиторов VEGF в возрасте от 1-го до 8-ми дней приводит к остановке роста и летальному исходу [8]. Ингибирование VEGF в неонатальном периоде у мышей приводит к апоптозу и регрессу васкуляризации, в то время как у взрослых особей такого эффекта не обнаружено, что указывает на изменение функции VEGF в ходе онтогенеза. Введение VEGF приводит к быстрому кратковременному повышению проницаемости сосудов. Основной точкой приложения VEGF являются клетки эндотелия, но митогенные и другие его эффекты были изучены и на других клетках, в том числе нейронах, VEGF вызывает хемотаксис моноцитов. VEGF активирует экспрессию оксида азота, простациклина.
При гипоксии повышается уровень гипоксия-индуцибельного фактора-1-альфа (HIF-1α), который активирует экспрессию VEGF. VEGF повышает проницаемость сосудов, ведет к дезорганизации сосудистой стенки, что усугубляет гипоксию и других цитокинов, способствующих вазодилатации
Гипероксия подавляет выработку VEGF, что приводит к апоптозу клеток эндотелия и запустеванию сосудов. В клинической практике гипероксия развивается при кислородной терапии у недоношенных детей. Недостаток VEGF в этой ситуации способствует развитию первой стадии ретинопатии недоношенных и БЛД [9].
Фактор роста эндотелия сосудов (VEGF) представляет собой индуцируемый гипоксией секретируемый белок, который взаимодействует с рецепторными тирозинкиназами эндотелиальных клеток, способствуя ангиогенезу. Недавние данные показывают, что VEGF также может действовать непосредственно на нейроны, вызывая нейротрофические и нейропротекторные эффекты. Например, VEGF стимулирует отрастание аксонов и улучшает выживаемость культивированных нейронов ганглиев верхних шейных и дорсальных корешков.
Цель исследования: выявить взаимосвязь между использованием кислородотерапией у недоношенных детей и развитием в дальнейшем заболеванием, доказать негативное влияние высоких концентраций кислорода на легкие и мозг
Актуальность: в современной медицине используют высокую концентрацию кислорода для восстановления новорожденных, но так ли это полезно или безвредно?
Задачи:
· Разобраться в влиянии концентрации кислорода на клетку
· Определить как кислородотерапия влияет на новорожденных
· Какие заболевания в последствии могут развиться у ребенка
·Установить опытным путем влияние повышенной концентрации кислорода на легкие и мозг
Гипотеза: высокая концентрация кислорода и длительная кислородотерапия пагубно влияет на организм недоношенного ребенка и стимулирует развитие хронических заболеваний.
Методы исследования:
· Обработка информации из различных статей
· Лабораторные исследования
Ход работы:
· Поиск нужной информации о прошлых исследованиях по этой теме
· Формулирование гипотезы
· Лабораторное исследование
Объект исследования: заболевания, вызванные высокой концентрации кислорода
Предмет исследования: влияние концентрации кислорода на развитие новорожденных.
Материалы и методы
Материал исследования – образцы ткани легкого и головного мозга опытной группы крыс линии Wistar возрастом 14 дней, содержащихся в условиях гипероксигенации (60% О2) с первого дня рождения, и контрольной группы, содержащейся в условиях нормоксии в Центре доклинических и трансляционных исследований (ЦДТИ) ФГБУ НМИЦ им. В.А. Алмазова (Центр). С помощью молекулярно-генетических методов на базе Института молекулярной биологии и генетики Центра было исследовано по 12 образцов из каждой группы.
Исследование уровня экспрессии гена VEGF проводилось в несколько этапов:
1.Получение суммарной РНК из иссследуемого материала.
2. Ревертирование суммарной РНК в комплементарную ДНК.
3. Постановка полимеразной цепной реакции в реальном времени (РТ-ПЦР).
Выделение суммарной РНК проводилось в вытяжном шкафу по следующей методике:
· Гомогенизация
Гомогенизировали 24 образца в растворе ExtractRNA и инкубировали лизат при комнатной температуре в течении 10 минут для полной диссоциации нуклеопротеидных комплексов. Далее поместили лизаты в центрифугу при 12000g на 10 минут для полного растворения фрагментов.
· Разделение фаз
Добавили 0,2 мл хлороформа и перемешали содержимое пробирок. инкубировали смесь в течение 5 минут при комнатной температуре, периодически встряхивая образец. Поместили в центрифугу на 15 минут при 12000g и 4 градусах Цельсия. После центрифугирования смесь разделилась на 3 фазы (нижняя- органическая фаза; средняя – интерфаза; верхняя – водная фаза). Аккуратно отбирали верхнюю водную фазу, содержащую РНК в новые пробирки.
· Выделение РНК
Добавили в водную фазу 0.5 мл 100% изопропанола. Инкубировали смесь при комнатной температуре в течение 10 минут. Для осаждения нуклеиновой кислоты открутили образцы в центрифуге 10 минут при 12000g . Отобрали супернатант, оставив осадок РНК на дне пробирки. С целью отмывки добавили 1 мл 75% этанола и центрифугировали на максимальной скорости в течении 5 минут при комнатной температуре. Удалили этанол. Высушили осадок на воздухе в пробирке с открытой крышкой в течение 5 минут. Добавили воду свободную от РНКаз и перемешали раствор с помощью вортекса. Образцы заморозили.
Следующим этапом было проведение ревертирования РНК в комплементарную ДНК. Для этого сначала провели измерение концентрации РНК в растворе. Для каждой пробы рассчитали объем, в котором будет содержаться 1 нг РНК. В образцы добавили ревертазу и нуклеотиды в соответствующих объемах. Поместили пробы в термоциклер. Установили программу ревертирования РНК. По окончании довели пробы до объема 100 мкл и заморозили.
Полученная комплементарная ДНК была исследована методом ПЦР-реакции в реальном времени. Для постановки реакции был приготовлен микс-раствор, содержащий полимеразу, нуклеотиды, прямой и обратный праймеры (VEGF и GAPDH в качестве референсного гена домашнего хозяйства). В специальный планшет внесли по 5 мкл образца и по 20 мкл микса, поставили в прибор для проведения реакции.
Результаты и обсуждение
Результаты, полученные с помощью ПЦР (real time) были обработаны стандартным методом, рассчитан коэффициент экспрессии VEGF в легких и мозге. Данные проанализированы с помощью статистической программы GraphPad Prism. В программе рассчитан критерий Манна-Уитни, в обоих случаях получен р<0,05, следовательно данные результаты можем считать достоверными.
Уровень экспрессии гена VEGF образцов легких в экспериментальной группе был значительно снижен по сравнению с контрольной группой, что можно объяснить повреждающим действием высокой концентрации кислорода на легочную ткань на молекулярном уровне. В клетках, синтезирующих данный фактор, вероятно были нарушены процессы транскрипции ДНК. (Рис.1)
С образцов мозга были получены обратные результаты (Рис.2). По сравнению с контрольной группой, в опытной - экспрессия гена VEGF была повышена. Из литературных данных мы знаем, что повышение экспрессии данного фактора наблюдается при гипоксических состояниях. Следовательно, ткани мозга животных в экспериментальной группе страдали от гипоксии, несмотря на то что, эта группа содержалась в условиях повышенного содержания кислорода в воздухе. Скорее всего это объясняется тем, что поврежденные кислородом легкие, не могли полноценно выполнять свою основную функцию – газообмен.
.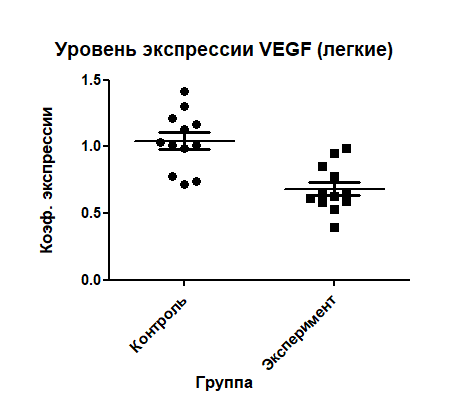
Рис.1 Уровень экспрессии гена VEGF в образцах ткани легких.
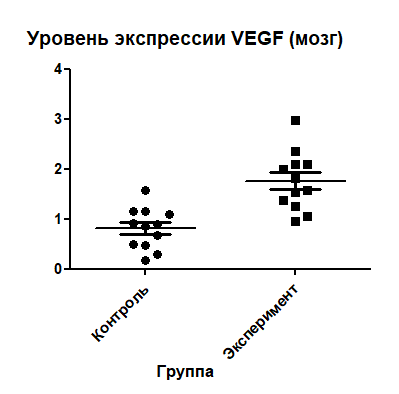
Рис.2 Уровень экспрессии гена VEGF в образцах ткани мозга.
Вывод:
Гипоксия мозга имеет серьезные последствия для здоровья человека, начиная с небольших неврологических нарушений заканчивая смертельным исходом. Наше исследование показало, что дыхание в условиях гипероксии может вызывать гипоксию головного мозга. Процедура оксигенотерапии, широко используемая в медицине, должна проводится под строгим контролем концентрации кислорода, особенно при поддержании недоношенных детей.
