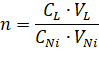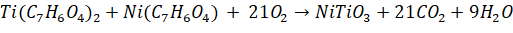Введение
Вода является важнейшим ресурсом, необходимым человеку для поддержания жизни. Быстрое развитие экономики и безответственные действия людей привели к поступлению в природные воды разнообразных загрязняющих веществ, негативно влияющих на окружающую среду. Актуальность решения проблем, связанных с загрязнением водных ресурсов, подтверждается наличием соответствующих государственных и международных Целей Устойчивого Развития (ЦУР), в число которых входит цель №6 «Чистая вода и санитария», а также наличие сразу 4 целей, касающихся воды, в рамках Национального проекта «Экология» («Чистая вода», «Оздоровление Волги», «Сохранение озера Байкал», «Сохранение рек и озер»).
Одними из распространенных типов загрязняющих веществ являются органические красители [4], представляющие собой соединения с высокой водорастворимостью, что приводит к неэффективности очистки от них воды обычными методами [3]. Органические красители наносят вред водным организмам, уменьшая светопроницаемость воды и снижая тем самым скорость метаболизма и уровень кислорода в воде [12]. Представителем этого класса соединений является краситель метиленовый синий (МС), широко применяемый в различных отраслях промышленности, прежде всего, текстильной [3,8]. Он ядовит, канцерогенен, не поддается биологическому разложению, представляет серьезную опасность для здоровья человека и оказывает негативное воздействие на экосистему. Попадание МС в организм человека может приводить к серьезным расстройствам, таким как рвота, тошнота, анемия и высокое кровяное давление [9].
Для удаления красителей из загрязненной воды используются различные процессы очистки, такие как окисление, коагуляция, фильтрация, озонирование, процессы обратного осмоса, ионный обмен, электрохимическое разложение, адсорбция и фотодеградация [3]. Среди них в настоящее время одним из наиболее перспективных является фотодеградация, преимущество которой перед другими методами состоит в возможности использования недорогой возобновляемой энергии. Среди различных методов фотокатализа, в свою очередь, наибольшее внимание привлекает применение наноразмерных фотокатализаторов [8].
Благодаря своей химической инертности, высокой стабильности в широком диапазоне рН, совместимости с другими материалами, относительной дешевизне и безвредности для окружающей среды, одним из наиболее привлекательных фотокатализаторов является диоксид титана TiO2 [10]. Однако он активируется только при облучении ультрафиолетовым светом, на долю которого приходится лишь небольшая доля (~5%) солнечного излучения по сравнению с видимой областью (~45%) [10]. Поэтому разработка фотокатализаторов на основе TiO2, работающих в видимом свете, является актуальным направлением исследований, так как позволит эффективно использовать солнечный свет. Для придания фотокаталитической активности TiO2 в видимом диапазоне используются различные подходы, в частности, включение в его структуру переходных металлов [6]. Например, было показано, что для разложения метиленового синего в видимом свете эффективным фотокатализатором является титанат никеля NiTiO3 [13]. Однако методика синтеза NiTiO3, предложенная авторами [13], была основана на использовании в качестве исходных реагентов неорганических соединений хлорида титана TiCl4 и нитрата никеля Ni(NO3)2, что требует продолжительной процедуры синтеза (ок. 10ч для получения осадка и ок. 6ч термического разложения) и высоких затрат энергии (термическое разложение проводится при температуре 650°С). Кроме того, TiCl4 представляет собой ядовитую жидкость, дымящую на воздухе. Таким образом, актуальной является проблема разработки безопасной и менее энергоемкой методики получения наноразмерного фотокатализатора NiTiO3. Возможным решением этой проблемы является использование в качестве исходных веществ комплексов Ti и Ni на основе природных органических соединений.
Цель работы: оценить возможность получения наноразмерных частиц NiTiO3, обладающих фотокаталитической активностью в видимом диапазоне спектра, на основе комплексов Ti и Ni с природным органическим соединением – 2,3-дигидроксибензойной кислотой (ДГБК). Выбор ДГБК был обусловлен ее широким распространением и различных живых организмах, включая растения и животных [11], а также тем, что ДГБК не классифицируется как обладающее острой токсичностью или опасное для водной среды вещество [14].
В задачи работы входил синтез исходных соединений Ni и Ti с ДГБК, получение наноразмерного титаната никеля NiTiO3 и проверка его фотокаталитической активности по отношению к МС.
Материалы и методы
Общая схема синтеза наночастиц (НЧ) NiTiO3 включала в себя раздельное получение органических комплексов Ti и Ni с их последующим совместным термическим разложением. Для получения НЧ Ti и Ni использовали золь-гель метод: на первом этапе из истинных растворов органических комплексов Ti и Ni получали золь – коллоидный раствор, который далее переводили в гель – коллоидный осадок. Полученные осадки высушивали, смешивали и подвергали термическому разложению. Подтверждение образования NiTiO3 проводили с помощью рентгенофазового анализа (РФА), любезно проведенного Центром коллективного пользования Российского университета дружбы народов имени Патриса Лумумбы. Для подтверждения фотокаталитической активности оценивали разложение МС в присутствии полученных НЧ.
Получение комплекса ДГБК с Ni. ДГБК характеризуется выраженными хелатирующими свойствами и может выступать как дипротонный лиганд салицилатного (COO–, орто-O–) или катехолатного (орто-O–, мета-O–) типа [11]. Известно, что ДГБК эффективно хелатирует Fe3+, Al3+, Mn2+, Cu2+ и Cd2+ [7], однако относительно мало известно о комплексообразовании ионов двухвалентных переходных металлов [11]. Поэтому на первом этапе изучали условия получения комплекса ДГБК с Ni, а именно, оптимальное соотношение ДГБК : Ni. Для этого к 5мл 0.05М раствора ДГБК в 50% растворе этилового спирта вносили 60мкл 0.05М NaOH для перевода ДГБК в депротонированную форму. Затем снимали электронный спектр полученного раствора ДГБК в ультрафиолетовом (УФ) диапазоне на спектрофотометре Cary 50 и определяли длину волны, соответствующую максимуму поглощения кислоты, выступающей в качестве лиганда (АL). Далее к раствору прибавляли аликвоты 0.05М раствора NiCl2 в 50% растворе этилового спирта с шагом 20мкл. Об образовании комплекса ДГБК с Ni судили по смещению максимума поглощения спектра в длинноволновую область, а по снижению АL – о падении концентрации свободной ДГБК.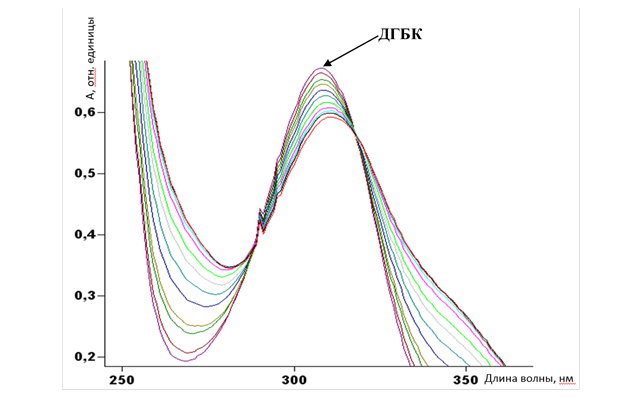
Рисунок1 – Электронные спектры поглощения ДГБК и его комплексов с Ni
На основании полученных данных строили зависимость АL от объема добавленного раствора NiCl2. На полученной зависимости точка перегиба соответствовала достижению точки эквивалентности, когда дальнейшее внесение металла не приводило к дополнительному образованию его комплексов с ДГБК. Точку перегиба находили путем построения касательных к двум участкам зависимости.
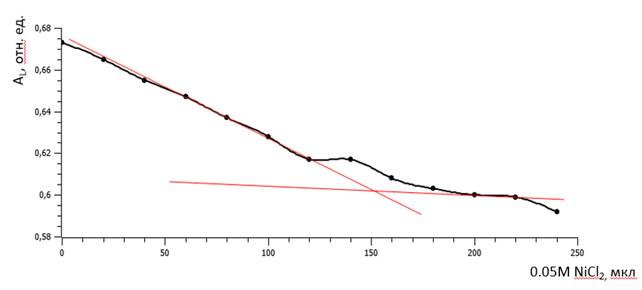
Рисунок 2 – Зависимость поглощения AL раствора ДГБК с Ni от количества внесенного металла: определение точки эквивалентности
На основании установленного объема раствора NiCl2 и его концентрации рассчитывали соотношение лиганда и соли металла n, необходимое для получения комплекса:
|
|
(1) |
где CNi и CL – концентрация раствора никеля и ДГБК соответственно, М; VNi и VL – объем раствора никеля и ДГБК соответственно, л.
Далее комплекс Ni с ДГБК получали при соотношении, определенном в описанных выше экспериментах. Полученный комплекс обозначали как Ni(C7H6O4).
Дополнительно определяли условия, при которых возможно получение устойчивого комплекса Ni с ДГБК. Для этого проводили сравнительное потенциометрическое титрование ДГБК и ее комплекса с Ni 0.05М NaOH, предполагая, что взаимодействие металла с дипротонным лигандом должно сопровождаться подкислением раствора вследствие замены протонов в структуре ДГБК на Ni.
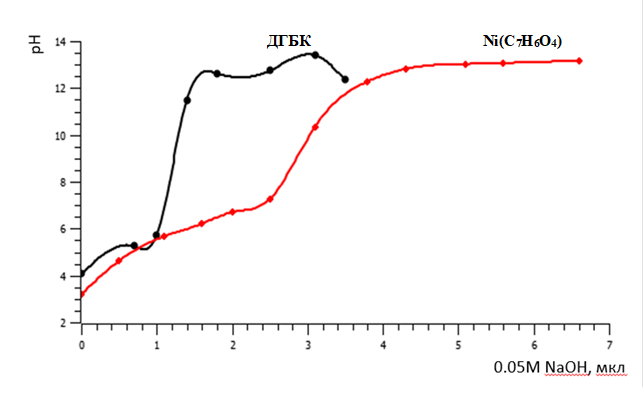
Рисунок 3 – Потенциометрическое титрование растворов Ni(C7H6O4) и ДГБК
Получение комплекса ДГБК с Ti. В качестве исходного соединения Ti был выбран тетрабутоксид титана (ТБТ). В водной среде он легко гидролизуется с образованием оксида титана и бутилового спирта. Гидролиз протекает очень быстро и идет с образованием плотного полидисперсного остатка, что в дальнейшем может мешать получению НЧ термодеструкцией; для замедления этого процесса с реакционную смесь вводят хелатирующие агенты [1]. В нашей работе в качестве лиганда мы использовали ДГБК, предполагая, что для образования комплекса на 1моль металла необходимо 2моля ДГБК. Для получения комплекса смешивали ТБТ с раствором ДГБК; полученный комплекс далее обозначали как Ti(C7H6O4)2.
Получение наночастиц NiTiO3. Для синтеза НЧ NiTiO3 на первом этапе получали гели комплексов ДГБК с Ni и Ti путем нагревания растворов комплексов до температуры 100°С. Образовавшиеся осадки отделяли фильтрованием через фильтр «Синяя лента» и высушивали на фильтре при температуре 120°С в сушильном шкафу в течение 2ч. Далее определяли воздушно-сухую массу полученных комплексов как разницу между массой фильтров с осадком после высушивания и массой фильтров после отделения осадка. Осадки отделяли от фильтра с помощью стеклянного шпателя и готовили смесь Ni(C7H6O4): Ti(C7H6O4)2 в соотношении 1:2 (масс.), являющемся наиболее эффективным для получения наноразмерного фотокатализатора [2]. Полученную смесь измельчали в керамической ступке с помощью керамического пестика. После этого измельченный осадок помещали в муфельную печь на 1.5ч при температуре 560°C, так как эта температура наиболее эффективна для получения наноразмерных частиц, а муфельная печь может обеспечить температуру во всем объеме [2]. Получение наноразмерных частиц при термическом разложении обеспечивалось образованием большого количества газа при разложении ДГБК:
|
|
(2) |
Для подтверждения состава полученного фотокатализатора проводили его анализ методом РФА.
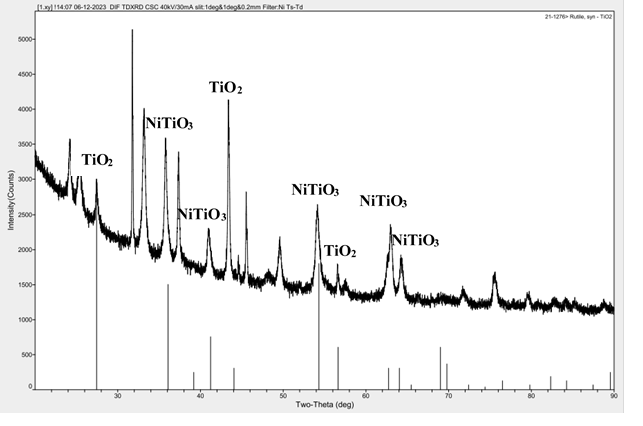
Рисунок4 – Дифрактограмма полученных НЧ
Оценка фотокаталитической активности наночастиц NiTiO3. После получения наноразмерного фотокатализатора NiTiO3 проводили проверку его эффективности для разложения МС. Для этого в 200мл МС в концентрации 6.83mМ вносили 0.85мг полученного фотокатализатора. Суспензию оставляли при комнатной температуре в условиях естественного освещения. Изменение концентрации метиленового синего оценивали спектрофотометрически через 30мин и через 48ч при длине волны 668нм, соответствующей максимуму поглощения МС. Концентрацию МС рассчитывали на основании значений молярного коэффициента поглощения МС 266885л/(моль×см).
Результаты и обсуждение
Анализ электронного спектра ДГБК показал, что в УФ области максимум поглощения наблюдается при 305нм (рисунок1), что соответствует ранее опубликованным данным для этого соединения [5]. При добавлении раствора NiCl2 происходило постепенное смещение максимума на электронных спектрах поглощения в длинноволновую область, что свидетельствует об образовании комплексного соединения ДГБК с Ni.
Построение зависимости поглощения при 305нм (AL) от количества внесенного Ni (рисунок2) показало, что постепенное снижение AL сменяется выходом на плато. Определение точки эквивалентности с использованием формулы (1) позволило установить, что необходимый объем NiCl2 составляет 151мкл, а рассчитанное по формуле (1) оптимальное соотношение ДГБК:Ni – 1:1. Поэтому в дальнейшем изучаемый комплекс получали при этом соотношении компонентов.
Оценка устойчивости комплекса Ni(C7H6O4) путем потенциометрического титрования показала, что во всем изученном диапазоне рН его растворов был ниже, чем рН ДГБК (рисунок3) вследствие замены протонов в ДГБК на ионы металла. Полученные результаты позволяют сделать вывод, что образующийся комплекс Ni(C7H6O4) устойчив в широком диапазоне рН, по крайней мере, в диапазоне 4–11.
Масса комплексов Ni(C7H6O4) и Ti(C7H6O4)2 была 0.075г и 0.155г соответственно; масса NiTiO3 после термического разложения составила 0.230г. РФА полученных наночастиц (рисунок4) показал присутствие пиков, соответствующих NiTiO3 и TiO2. Наличие в полученных НЧ TiO2 в смеси после прокаливания может объясняться, по-видимому, неполным связыванием Ti в комплексы с ДГБК, что привело к быстрому гидролизу ТБТ с образованием TiO2. Однако проверка высказанного предположения требует проведения дополнительных исследований, направленных на оптимизацию получения Ti(C7H6O4)2.
Оценка фотокаталитической активности полученных НЧ показала, что снижение интенсивности цвета МС наблюдается уже через 30мин после их внесения; через 48ч обесцвечивание становится еще более выраженным. Определение поглощения растворов МС при 668нм подтвердило визуальные наблюдения. Как показали проведенные расчеты, применение NiTiO3 позволило снизить концентрацию МС за 48ч с 6.83мкМ до 4.82мкМ, т.е. на 30%. Сходная фотокаталитическая активность ранее была показана для NiTiO3 по отношению к метиленовому оранжевому [6]. Принимая во внимание отсутствие дополнительных источников освещения при фотодеградации, полученные результаты позволяют говорить о хорошей фотокаталитической активности синтезированных НЧ NiTiO3 в видимом диапазоне спектра.
Выводы
1.Образование комплексов ДГБК с Ni эффективно протекает при соотношении ДГБК:Ni 1:1; комплекс Ni(C7H6O4) устойчив в диапазоне рН от 4 до 11.
2.Совместное термическое разложение комплексов Ni(C7H6O4) и Ti(C7H6O4)2 в соотношении 1:2 в течение 1.5ч при температуре 560°C позволяет получить наночастицы NiTiO3 с примесью TiO2.
3.Полученный наноразмерный фотокатализатор обладает хорошей фотокаталитической активностью по отношению в МС при естественном освещении: за 48ч концентрация МС снижается на 30%.