Теоретическая часть
Классический список семи чудес света известен нам еще со школьных времен, когда мы изучали Древнюю историю. Античная эпоха своими величайшими культурно-историческими памятниками положила начало выдающимся творениям человечества, которые продолжают наследие с новыми открытиями и подлинными чудесами.
В классический список чудес света входят:
Пирамида Хеопса (место захоронения фараона Египта) – создали египтяне в 2540 г. до н. э.;
Висячие сады Семирамиды в Вавилоне – создали вавилоняне в 605 г. до н. э.;
Статуя Зевса в Олимпии – создали греки в 435 г. до н.э.;
Храм Артемиды в Эфесе (построен в честь богини Артемиды в Турции) – создали греки и персы в 550 г. до н. э.;
Мавзолей в Галикарнасе – создавали карийцы, греки и персы в 351 г. до н. э.;
Колосс Родосский – был установлен греками между 292 и 280 гг. до н. э.;
Александрийский маяк – построенный в IV веке до н. э. греками маяк, и названный в честь Александра Македонского.
До наших времен дошли только пирамиды Египта, которые может увидеть каждый, кто посетит эту страну. Пирамида Хеопса в Гизе является единственным сохранившимся чудом света. Остальные чудеса – Колосс Родосский, висячие сады Семирамиды, Александрийский маяк – разрушились в течение веков, одни при пожарах и землетрясениях, другие из-за наводнения.
В 9 классе, на уроках химии мы изучали металлы. Отдельным вопросом были металлы в истории. И я захотела узнать больше об этом, ведь в учебнике слишком мало примеров переплетения истории с химией металлов. Какие только сооружения и изобретения не были связаны с ними! Но мне показалось интересным, что металлы применялись в различных целях еще до нашей эры и даже были использованы при создании всем известных семи чудес света!
В своей работе я решила исследовать, какую роль сыграли металлы в существовании чудес света, какие химические процессы могли происходить с ними во времени.
Объект исследования: металлы: медь, свинец, железо, олово и золото.
Предмет исследования: чудеса света.
Цель: проанализировать химические процессы, происходящие с металлами за время существования чудес света.
Гипотеза: чтобы использовать металлы в разных сферах человеческой деятельности необходимо знать, какие химические процессы могут происходить с ними.
Задачи:
• изучить литературу по данной теме;
• проанализировать химическую и электрохимическую коррозию металлов;
• сделать выводы о роли металлов в создании чудес света.
Методы исследования:
• обзор литературы по данной теме, материалы источников Интернет;
• анализ химических реакций, происходивших с металлами.
Историческая справка о чудесах света, в которых использовались металлы и сплавы
Колосс Родосский
Колосс Родосский – 30–метровая бронзовая статуя бога солнца Гелиоса украшала порт в городе на Родосе (остров в Эгейском море, вблизи от Турции) и служила маяком. В 220г. до н. э. был разрушен землетрясением и больше не восстанавливался. Мы не знаем точно, как выглядела статуя и где она стояла. Но знаем, что для создания такой статуи потребовалось 500 талантов бронзы и 300 талантов железа (по современным меркам это около 13 тонн бронзы и 8 с лишним тонн железа). Колосса строили при помощи каменной основы, скреплённой железом и отделанной бронзой. Лицо его было обработано золотом. Строители находились на земляных насыпях, наложенных вокруг него, на возведение статуи ушло 12 лет. Работа с железом в древности считалась колдовской и поэтому опасной. Даже сегодня некоторые племена, живущие в Сахаре, считают кузнецов людьми, продавшими душу дьяволу, так что в этих местах кузнец профессия исключительно потомственная. Древние греки, хотя и были самыми цивилизованными представителями своего времени и великими изобретателями (ученые мужи этого народа еще на заре человечества изобрели массу полезных предметов – от топора и клея, до гидравлических роботов) однако, и им кузнечное дело внушало ужас. Кузница бога огня Гефеста находилась по их убеждению в недрах вулкана Этна, а отголоски особенно сильных ударов молота о наковальню, доносившихся оттуда, отзывались на простых смертных страшнейшими землетрясениями. Поэтому то, на что решились жители острова Родос, заставляет относиться к ним с большим почтением. Они решили построить на своей родине гигантскую статую бога солнца Гелиоса в благодарность за то, что «в давние времена, когда Родос был еще погружен на дно, вынес его Гелиос на поверхность и попросил у богов для себя» и сделать ее не из камня, а из металла.
Александрийский маяк
Во времена правления Птолимея 1 Александрия превратилась в богатый и процветающий город-порт, которому не хватало лишь собственного символа, а также заметного берегового ориентира, указывающего торговым кораблям путь в устье городской гавани. Тогда в 290 году до н.э. правитель Птолемей I приказал как можно быстрее возвести на небольшом островке Фарос маяк. Верхняя (третья) часть маяка была сооружена в форме цилиндрической колоннады – 8 колонн несли купол, увенчанный 8–метровой бронзовой фигурой повелителя морей Посейдона (или статуей Зевса Спасителя). Верхняя башня формой напоминала цилиндр, в котором горел огонь, помогавший кораблям благополучно достигнуть бухты. За пламенем стояли бронзовые пластины, направлявшие свет в море. С кораблей можно было видеть этот маяк на расстоянии до 50 км. К XII веку н.э. александрийская бухта настолько заполнилась илом, что корабли больше не могли ею пользоваться. Маяк пришел в упадок. Бронзовые пластины, служившие зеркалами, вероятно, переплавили на монеты. В XIV веке маяк был уничтожен землетрясением. Несколькими годами позже мусульмане использовали его обломки, чтобы построить военный форт. Форт впоследствии не раз перестраивался и до сих пор стоит на месте первого в мире маяка.
Сады Семирамиды
Легенда о висячих садах Семирамиды гласит, что их возвел вавилонский царь Навуходоносор для своей жены. Царица Амитис была родом из Мидии – страны, которая отличалась мягким климатом, поросшими зеленью горами, огромными фруктовыми садами и лучшими цветами. В жарком песчаном Вавилоне она чувствовала себя будто посреди пустыни, особенно когда Навуходоносор уходил в долгие походы. Так царь повелел в утешение своей супруге необычное сооружение.
В архитектурном плане «висячие сады» представляли собой пирамиду, состоявшую из четырех ярусов-платформ. Их поддерживали колонны высотой до 25 метров. Нижний ярус имел форму неправильного четырехугольника, наибольшая сторона которого составляла 42 м, наименьшая – 34 м. Чтобы предотвратить просачивание поливной воды, поверхность каждой платформы сначала покрывалась слоем тростника, смешанного с асфальтом, затем двумя слоями кирпича, скрепленного гипсовым раствором, поверх всего укладывались свинцовые плиты. На них толстым ковром лежала плодородная земля, куда были высажены семена различных трав, цветов, кустарников и деревьев. Пирамида напоминала вечно цветущий зеленый холм. В полости одной из колонн помещались трубы, по ним вода из Евфрата насосами постоянно подавалась на верхний ярус садов, откуда она, стекая ручейками и небольшими водопадами, орошала растения нижних ярусов. А сам «водопровод» был сделан также из свинца.
Статуя Зевса в Олимпии
Говорят, статуя Зевса в Олимпии оказалась настолько величественной, что когда Фидий, создав её, спросил у своего творения: «Доволен ли ты, Зевс?» – грянул гром, а чёрный мраморный пол у ног бога треснул. Громовержец оказался доволен. Он с этим городом был связан самым непосредственным образом – именно здесь ему удалось победить своего отца, Крона, которому было предсказано, что один из его сыновей лишит его власти. Чтобы этого избежать, он решил проблему довольно кровожадным способом – пожирал всех появившихся на свет мальчиков. Повезло лишь Зевсу: его мать, Рея, сумела спасти младенца. Чтобы достойным образом отметить это событие, жители города решили раз в четыре года проводить Олимпийские игры, а через триста лет после их начала, в 471 г. до н.э., ими было принято решение построить для Громовержца достойное его святилище и установить в нем скульптуру бога. Процесс этот оказался долгим – строительные работы длились пятнадцать лет и открытие храма состоялось в 456 г. до н.э.
Из золота были сделаны: накидка, которая закрывала часть тела Зевса, скипетр с орлом, который он держал в левой руке, статуя богини победы – Ника, которую он держал в правой руке и венок из ветвей оливы у Зевса на голове.
Зевс восседал на троне, инкрустированном черным деревом и драгоценными камнями. Законченная статуя достигала 13 м в высоту и почти касалась потолка храма. После своего завершения в 435 г. до н.э. статуя на протяжении 800 лет оставалась одним из величайших чудес света. Около 40 г. н.э. римский император Калигула захотел перенести статую в Рим. За ней были посланы рабочие, но, согласно легенде, статуя разразилась взрывом смеха, и рабочие разбежались. Затем, в 391 г. н.э., после принятия христианства, римляне запретили Олимпийские игры и закрыли греческие храмы. Несколько лет спустя статую Зевса перевезли в Константинополь. В 462 г. н.э. дворец, в котором стояла статуя, был уничтожен пожаром. В Олимпийской области в VI веке случилось землетрясение. Храм и стадион были разрушены наводнениями, остатки их покрыты илом. Это помогло фрагментам Олимпии просуществовать более тысячи лет.
Храм Артемиды
Крез был последним царем Лидии, древней области в Малой Азии, входящей в территорию современной Турции. Он славился своим огромным богатством и в 560 году до н.э. построил в Эфесе величественный храм. Крез решил построить храм в честь богини луны, покровительницы животных и молодых девушек. Греки звали ее Артемидой, а римляне – Дианой. Храм был построен из известняка и мрамора, добывавшегося рабочими в близлежащих горах. Несущие конструкции храма составляли около 120 мраморных колонн. Гигантские колонны достигали в высоту 20 метров. Огромные глыбы, из которых они складывались, приходилось ставить на место с помощью блоков, после чего их скрепляли металлическими штырями. Когда здание покрыла крыша, художники придали ему законченный вид, украсив скульптурами и орнаментами. В центре храма стояла статуя Артемиды в виде матери-кормилицы (15 м).
Скульптура была выполнена из дерева, одежда и украшения – из золота.
Это был один из крупнейших храмов классики, намного превосходивший размерами Парфенон, построенный позже в Афинах. Платформа, на которой он стоял, достигала 131 метра в длину и 79 метров в ширину.
Двести лет спустя, в 356 году до н.э., храм был сожжен дотла. По странному совпадению, храм был уничтожен в тот самый день, когда родился Александр Великий. Спустя годы, Александр посетил Эфес и приказал восстановить храм на прежнем месте. Храм Александра просуществовал до III века н.э.
Химическая суть коррозии металлов
Если посмотреть на чудеса света с другой стороны, химической, то скорее всего свою роль сыграли недочеты при проектировании, или тогдашнее незнание каких-то процессов.
Первое с чем знакомится химик, при анализе чего-либо – это коррозия.
Коррозия – физико-химическое взаимодействие металлического материала и компонентов среды, приводящее к ухудшению эксплуатационных свойств материала, среды или технической системы, частями которой они являются.
В основе коррозии металлов лежит химическая реакция между материалом и средой или между их компонентами, протекающая на границе раздела фаз. Чаще всего это окисление металла. Стехиометрия процесса коррозии проста. Но на самом деле это один из сложнейших гетерогенных процессов, характеризующийся многостадийностью и сложностью образующихся продуктов.
По механизму взаимодействия металла со средой выделяют:
а) химическую коррозию,
б) электрохимическую коррозию.
Химическая коррозия протекает в атмосфере агрессивных газов, не содержащих влаги, а также в присутствии неэлектролитов и заключается в возникновении химической реакции между металлом и коррозионной средой.
Электрохимическая коррозия возникает при контакте металла с раствором электролита. Этот вид коррозии встречается наиболее часто в водоемах, в почве, в атмосфере влажного воздуха и морской воде. При атмосферной коррозии на поверхности металла конденсируется вода, в которой растворяются содержащиеся в воздухе газы (О2,CО2,SО2 и др.), образуя электропроводящие растворы.
Коррозия железа
Первым чудом света, про которое я начала рассказывать, был Колосс Родосский. Он состоял из железа и бронзы. Пожалуй, с железа и начнем. Железо – ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: при высоких температурах или при высокой влажности на воздухе железо быстро корродирует.
При химической коррозии идет окисление металла без возникновения цепи электрического тока:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3).
Оксидная пленка железа очень рыхлая и не прилегает плотно к поверхности металла, поэтому кислород проникает все дальше и дальше, коррозия идет до полного разрушения предмета.
Атмосферная коррозия железа протекает в условиях хорошего доступа кислорода и во влажной среде, поскольку на металле всегда присутствует пленка воды, которая конденсируется из атмосферы. Таким образом, коррозия протекает по электрохимическому механизму с кислородной деполяризацией. Некоторые участки поверхности железа служат анодом, на котором происходит его окисление:
Fe (тв.) = Fe2+ (водн.) + 2e, E °окисл = 0,44 B.
(E° – стандартный электродный потенциал).
Образующиеся при этом электроны перемещаются по металлу к другим участкам поверхности, которые играют роль катода. На них происходит восстановление кислорода:
O2 (г.) + 4H+ (водн.) + 4e = 2H2O (ж.),
E °восст = +1,23 B.
Этот процесс иллюстрируется на рис. 1.
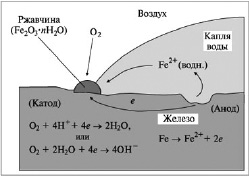
Рис. 1. Схема электрохимической коррозии железа без контакта с другими металлами
В восстановлении кислорода участвуют ионы Н+. Если концентрация Н+ понижается (при повышении рН), восстановление О2 затрудняется. Замечено, что железо, находящееся в контакте с раствором, рН которого выше 9–10, не корродирует.
В процессе коррозии образующиеся на аноде ионы Fe2+ окисляются до Fe3+:
4Fe2+ (водн.) + O2 (г.) + (2n + 4)H2O (ж.) = =2Fe2O3•nH2O (тв.) + 8H+ (водн.).
Поскольку роль катода обычно играет та часть поверхности, которая лучше всего обеспечена притоком кислорода, ржавчина чаще всего появляется именно на этих участках. Если вы внимательно осмотрите лопату, простоявшую некоторое время на открытом воздухе с налипшей на лезвии грязью, то заметите, что под грязью на поверхности металла образовались углубления, а ржавчина появилась повсюду, куда мог проникнуть О2.
Таким образом, под действием влажного, насыщенного солями средиземноморского воздуха, железный каркас Колосса Родосского разрушился.
Коррозионные свойства других металлов
Железный каркас Колосса был покрыт бронзой. Кроме того, и в Александрийском маяке использовалась бронза.
Бронза – это цветной сплав на основе меди, определяющей большую часть его характеристик. Производить и использовать бронзу для изделий различного назначения человек начал еще с древних времен, о чем свидетельствуют результаты археологических раскопок. Изначально использовалась бронза, состав которой был обогащен оловом. К сплавам данного типа относится, в частности, так называемая колокольная бронза (из нее на протяжении многих веков отливали колокола).
Медь. Древние греки называли этот элемент халкосом, на латинском она именуется cuprum (Сu) или aes, а средневековые алхимики именовали этот химический элемент не иначе как Марс или Венера. Человечество давно познакомилось с медью за счет того, что в природных условиях ее можно было встретить в виде самородков, имеющих зачастую весьма внушительные размеры.
Химическая активность меди мала. Медь в условиях сухой атмосферы изменяется незначительно (можно даже сказать, что почти не изменяется): практически не окисляется, с водой не взаимодействует и является довольно инертным металлом.
С кислородом в зависимости от температуры взаимодействия медь образует два оксида:
– при 400–500°С образуется оксид меди (II):
2Cu + O2 = 2CuO;
– при температуре выше 1000°С получается оксид меди (I):
4Cu + O2 = 2Cu2O.
А вот при повышении влажности и наличии в окружающей среде углекислого газа на ее поверхности обычно формируется пленка зеленоватого оттенка. В ней присутствует CuCO3 и Cu(OH)2, а также различные сернистые медные соединения.
2CuO + СО2 + Н2 О = CuCO3 + Cu(OH)2 = =(CuOH)2СО3 (Cu2CO3 (OH)2)
карбонат гидроксомеди (II), малахит
Указанную зеленоватую пленку именуют патиной. Она защищает от разрушения металл.
Бронза – сплав меди с оловом. Олово – металл, служивший человеку с незапамятных времен. Физические свойства олова обеспечили его основополагающую роль в истории человечества. Без него невозможно существование бронзы, остававшейся на протяжении многих веков единственным сплавом, из которого человек изготовлял практически все – от орудий труда до ювелирных украшений.
У олова свойства достаточно мягкого металла. Относится к легкоплавким металлам. Олово просто сплавляется с другими металлами, что обеспечивает его обширное применение в промышленности. Олово – металл, по-разному реагирующий на химические воздействия.
Химические свойства олова определяются его положением в периодической системе элементов Д. И. Менделеева и предусматривают амфотерность, т. е. способность проявлять как основные, так и кислотные свойства. Напрямую зависят от полиморфизма олова физические свойства. Полиморфизм (аллотропия) – физическое явление, основанное на перестроении атомов или молекул веществ в твердом состоянии, что влечет за собой изменение их свойств. Каждая полиморфная модификация устойчиво существует только в строго определенном интервале значений температур и давлений.
При контакте олова с медью возникает гальваническая пара Sn – Cu. При попадании этой гальванической пары в раствор электролита происходит процесс электрохимической коррозии. В атмосферных условиях роль электролита играет водная пленка, в которой могут быть растворены газы O2, CO2, SO2, H2S, NO2, NH3 и др. При электрохимической коррозии анодом в гальванической паре становится металл, обладающий меньшим значением электродного потенциала, а катодом – металл с большим значением электродного потенциала. Поскольку в электрохимическом ряду напряжений медь стоит правее, чем олово, то медь имеет большее значение электродного потенциала восстановления, чем олово. Значит, в данной гальванической паре медь будет катодом, а олово – анодом.
Eo(Sn(2+)/Sn) = – 0,140 B
Eo(Cu(2+)/Cu) = + 0,338 B
Eo(Cu(2+)/Cu) > Eo(Sn(2+)/Sn)
При электрохимической коррозии на аноде происходит окисление (разрушение) металла.
Me(0) – ne → Me(n+)
На катоде во «влажном воздухе» в зависимости от газового состава атмосферы могут протекать два основных процесса – восстановление молекулярного кислорода или восстановление ионов водорода.
2H2O + О2 + 4e → 4OH(–)
(рН ≥ 7 – среда нейтральная или слабощелочная)
2Н (+) + 2е → Н2↑
(рН < 7 – среда кислая)
Электрохимическая коррозия во «влажном воздухе» в атмосфере кислорода воздуха.
Процессы окисления-восстановления на электродах:
Анод (-) Sn(0) – 2е → Sn(2+) – процесс окисления на аноде.
Катод (+) 2H2O + О2 + 4e → 4OH(–) – процесс восстановления на катоде.
Суммируя реакции на аноде и катоде, получаем уравнение, которое в ионной форме выражает происходящую в гальванической паре реакцию.
2Sn(0) + 2H2O + О2 → 2Sn(2+) + 4OH(–)
Уравнение электрохимической коррозии в молекулярной форме.
2Sn + 2H2O + О2 → 2Sn(OH)2↓
Схема гальванической пары:
Анод (–) Sn | H2O + О2 | Cu Катод (+)
Таким образом, на поверхности сплава, расположенного под коррозионными слоями, можно наблюдать коррозию, зависящую от состава самого сплава, например на оловосодержащих бронзах образуются частички диоксида олова SnO2.
Затем меня заинтересовал вопрос: как происходит электрохимическая коррозия олово-железо, медь-железо.
Олово-железо В данной паре олово служит катодом в электрохимическом процессе. При воздействии воздуха и влаги на железо олово ускоряет процесс коррозии. Сравнение окислительных электродных потенциалов железа и олова показывает, что железо окисляется легче олова:
Fe (тв.) = Fe2+ (водн.) + 2e, E °окисл = 0,44 B,
Sn (тв.) = Sn2+ (водн.) + 2e, E °окисл = 0,14 B.
Поэтому железо служит в этом случае анодом и окисляется, как показано на рис. 2.
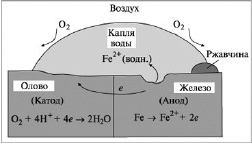
Рис. 2. Схема электрохимической коррозии при контакте железа и олова
Пара медь – железо. Железо в ряду левее, и оно разрушается. Если железо находится в контакте с медью в атмосфере влажного воздуха (рис. 3), то менее активный металл медь выступает в роли катода, на котором происходит восстановление окислителя, а материал анода окисляется.
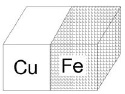
Рис. 3. Атмосферная коррозия в результате контакта меди и железа
Возникает гальваническая пара, при работе которой происходят процессы:
Анод: Fe0 – 2ē → Fe2+;
Катод: О2 + 2Н2O +4ē → 4OН–.
Далее происходят вторичные процессы:
Fe2+ +2OH– → Fe(OH)2;
4Fe(OH)2 +O2 + H2O → 4Fe(OH)3;
2Fe(OH)3 → Fe2O3 + 3H2O.
Образующийся гидроксид железа (II) легко окисляется кислородом воздуха, что в конечном итоге приводит к образованию ржавчины mFe2O3·nFeO·pH2O.
В создании садов Семирамиды использовались свинцовые плиты.
Свинец – типичный металл, тяжелый, плотный, имеет голубовато-серый цвет. Блеск на воздухе быстро исчезает, так как металл покрывается защитной оксидной пленкой. Свинец довольно распространен и легко добывается, чем и объясняется его столь давняя известность. На воздухе свинец быстро покрывается тонким слоем оксидной пленки, защищающего его от дальнейшего окисления. Вода сама по себе не взаимодействует со свинцом, но в присутствии воздуха свинец постепенно разрушается водой с образованием гидроксида свинца (II): 2Pb+O2+2H2O =2Pb(OH) 2 – может поступать из водопроводных труб. Все растворимые соединения свинца ядовиты. Соли, отвечающие несуществующей в свободном состоянии свинцовой кислоте H2PbO3, называются плюмбатами.
Природа образования токсического иона свинца:
Pb(OH)2 +2OH- = PbO2–2 +2H2O.
В случае небольшого количества СО2 в воде в месте контакта олово покрывается защитной пленкой PbСO3:
2 Pb + 2СО2 + O2 (+ 2H2O) = 2PbСO3.
В случае высокого содержания СО2 в воде свинец корродирует, превращаясь в растворимый гидрокарбонат свинца:
2 Pb + 4СО2 + O2 + 2H2O = 2 Pb(HСO3)2.
Из-за того, что вода постепенно отравляется свинцом, свинцовые трубы для водопроводов не применяют, несмотря на низкую химическую активность свинца и довольно высокую коррозионную устойчивость свинца.
А вот такой металл, как золото был обнаружен в постройке статуи Зевса и статуи Артемиды. Некоторые свойства золота сделали его одним из самых ценных металлов на Земле. Чистое золото – это элемент и минерал. Люди ценят его за привлекательный внешний вид, способность длительное время сохранять яркий цвет и ряд других уникальных свойств. Золото было названо самыми красивым из всех химических элементов. Это первый металл, который люди стали использовать в чистом виде. Он применяется в создании произведений искусства на протяжении тысяч лет.
Золото представляет блестящий металл желтого цвета. В процессе нагревания происходит его окисление и появляется красноватый оттенок (червонный). Металл имеет достаточно хорошие отражательные свойства, пластичный и легко полируется. 1 г Au возможно раскатать в лист толщиной не более 0,0001 мм или растянуть в длинную проволоку (до 3,5 м). Золото из-за его мягкости в чистом виде почти не применяется. Сплавы с иными металлами снижают температуру плавления, изменяя механические характеристики Au. Это свойство давно используется в производстве: для нанесения позолоты на произведения искусства. В химическом отношении – Au, как все благородные металлы, пассивный химический элемент. Вещество не окисляется на воздухе, проявляет инертность к большинству как неорганических, так и органических веществ.
Заключение
Металл служит примером прочности. Недаром, когда хотят подчеркнуть это свойство, говорят: «прочный, как сталь». С понятием «металл», «металлический», «стальной» связано представление о чем-то неизменном, твердом, прочном. Однако, когда мы знакомимся с остатками вооружения наших предков, извлеченных при раскопках древних могил, то мы видим, что когда-то блестящие и прочные мечи, топоры, стальные кольчуги и другие металлические изделия потеряли блеск и прочность. Такому разрушению подвергаются металлические предметы, не только оставленные в земле, но и находящиеся в сырой среде. Следовательно, металлы оказываются далеко не такими прочными, как об этом гласит народная молва. «Поедать» металл готовы все вещества, которые могут с ним реагировать: кислород, вода, кислоты, соли (особенно содержащиеся в морской воде). Под действием разрушительных процессов окисления металлов предметы теряли функциональность, деформировались и приходили в негодность, и нужно было искать способы их защиты.
Выводы
Проблема металлов заключается не столько в них самих, как в химических процессах, которые происходят с ними. Пожалуй, самая главная из них – это электрохимическая коррозия.
Электрохимическая коррозия металлов – одна из насущных проблем человечества с того момента, как в производстве различных, необходимых человеку предметов, стали использоваться изделия из металла.
В результате проделанной работы я могу сделать вывод, что металлы, с одной стороны, помогли людям в возведении чудес света. Однако судьба чудес света была предрешена уже на этапе строительства. С течением времени металлы и сплавы корродировали, что, несомненно, являлось одной из причин разрушения памятников древности.
Библиографическая ссылка
Самохина Н.И. ЧУДЕСА СВЕТА ГЛАЗАМИ ХИМИКА // Международный школьный научный вестник. 2019. № 5-1. ;URL: https://school-herald.ru/ru/article/view?id=1156 (дата обращения: 12.03.2026).
