В конце 50-х годов прошлого столетия академиком Н. М. Эмануэлем была высказана гипотеза о том, что для понимания молекулярных механизмов развития различных патологических состояний важное значение могут иметь проявления биофизических сдвигов, связанных с изменением содержания свободных радикалов в тканях при лучевом поражении и злокачественном росте. Многочисленные исследования, выполненные в нашей стране и за рубежом в последующие годы, позволили установить, что протекание многих патологических состояний сопровождается изменением интенсивности процессов перекисного окисления липидов.
На основе общности физико-химических свойств и поведения свободных радикалов в химических и биологических системах было предложено использовать малотоксичные ингибиторы свободнорадикальных процессов (в частности, ингибиторов) первоначально в качестве радиозащитных и противоопухолевых агентов. В настоящее время антиоксиданты применяются для нормализации гомеостаза окислительных реакций при многих патологических состояниях.
Однако в самые последние годы четко обозначился интерес к водорастворимым антиоксидантам на основе замещенных дитретбутилфенолов, как антиоксидантам с расширенным потенциалом биологического действия и как более эффективным антиоксидантам, позволяющим сократить терапевтическую дозу
Во время исследования пространственно-затрудненных фенолов был выявлен недостаток – использование в биологических экспериментах их масляных растворы высокой концентрации. Н.М. Эмануэль предложил начать синтез соединений, которые, имея структуру ПЗФ, были бы водорастворимыми [1].
Водорастворимые фенольные антиоксиданты отличаются от своих гидрофобных аналогов тем, что имею большую биологическую доступность и скорость транспорта в организме, поэтому их синтез и исследование свойств является актуальным.
Целью данной исследовательской работы является изучение водорастворимых биологически активных соединений класса пространственно-затрудненных фенолов.
Объектом исследования был выбран агидол-3 и его водорастворимые производные, полученные в реакции с фосфористой кислотой.
Для достижения данной цели были поставлены следующие задачи:
• провести анализ литературных источников по биологической активности пространственно-затрудненных фенолов;
• синтезировать агидол-3(Основание Манниха-1) в лаборатории кафедры органической химии КНИТУ по известной методике;
• провести реакцию агидола-3 с фосфористой кислотой с целью получения водорастворимого соединения;
• выполнить компьютерный прогноз биологической активности и токсичности агидола-3 с помощью программы PASS и Gusar.
Почти каждое химические соединение обладает биологической активностью при определенном способе введения его в организм.
Поэтому под определением биологически активных веществ (БАВ) следует подразумевать химические соединения, которые необходимы для поддержания жизнедеятельности живых организмов и обладают при использовании небольших концентрация высокой физиологической активностью по отношению к определенным группам живых организмов или их клеткам [2].
Одно и то же биологически активное вещество, воздействуя на один животный организм, ткани и клетки, проявляет разную биологическую активность в зависимости от различных факторов.
Часто в медицинской и фармакологической практике используется такое понятие, как ЛД50 – т.е. концентрация вещества, при введении которой половина испытуемых животных погибает. Это мера токсичности БАВ[3].
Общая классификация делит БАВ на: эндогенные и экзогенные.
К первым веществам относят химические элементы, низкомолекулярные соединения и высокомолекулярные субстанции. Экзогенными считаются биологически-активные соединения (БАВ), поступающих в организм растений, животных, человека различными путями[3].
Пространственно-затрудненные фенолы (ПЗФ) имеют высокую биологическую активность и широко применяются в лечебной практике, обладают значительно меньшей токсичностью относительно их незамещенных аналогов, обладают отчетливо выраженным бактерицидным и фунгицидным действием.
Академиком Н.М. Эмануэлем изучены различные аспекты влияния ПЗФ и их производных на процессы, возникающие в результате действия на биологический субстрат проникающего излучения или протекающие в опухолевых клетках. Во многих случаях возникновение злокачественных новообразований можно объяснить появлением в биосубстрате свободных радикалов [4].
Губительное воздействие свободных радикалов на живой организм вызывает повреждение белков, нуклеиновых кислот и липидных мембран, что приводит к форсированию развития старения и возникновению целого ряда патологий. Для подавления разрушительных свободно-радикальных процессов эффективно используются природные и синтетические фенольные антиоксиданты [4].
Одними из таких фенольных антиоксидантов являются пространственно-затрудненные фенолы, которые содержат в орто-положениях объемистые трет-алкильные заместители. Данные соединения способны останавливать радикальные процессы окисления с помощью фенольной гидроксильной группы, активность которой зависит от заместителей в орто и пара-положениях. Трет-алкильные заместители в орто-положении противоречиво оказывают действие на гидроксильную связь. Они создают значительные стерические препятствия, что приводит к увеличению стабильности гидроксильной связи. И вызывают небольшое отклонение гидроксильной группы от копланарности, вследствие взаимодействия электронных оболочек гидроксильной и трет-бутильных групп, что приводит к удлинению гидроксильной связи и к уменьшению ее прочности. В итоге отрыв атома водорода от гидроксила становится достаточно легким [6].
Также на свойства фенолов влияют заместители в пара-положении. Электронодонорные заместители в параположении повышают общую π-электронную плотность у кислородного атома, что усиливает гомолитический разрыв гидроксильной связи. Влияние электроноакцепторного заместителя является обратным в силу оттягивания электронов и размазыванию электронной плотности по ароматическому кольцу [7].
Механизм ингибирующего действия пространственно-затрудненных фенолов цепных реакций сводится к отрыву радикалом атома водорода от гидроксильной группы фенола. Продуктом реакции является феноксильный радикал, у которого сохраняется свободная валентность:
ArOH + RO2∙ → ArO∙ + ROOH∙
Эффект замедления достигается за счет образования более стабильного феноксильного радикала, который почти не участвует в реакциях продолжения цепей [7].
Некоторые из класса соединений пространственно-затрудненных фенолов обладают ярко выраженной антирадикальной активностью.
Таким образом, пространственно-затрудненные фенолы имеют высокую биологическую активность и широко применяются в медицине. Они обладают высокой антиоксидантной способностью. Наиболее активные среди них – производные пирокатехина и резорцина.
Авторами выполнен поиск литературы, её обработка; проведен синтез и очистка анализируемого вещества и синтез водорастворимых производных,а также проведено прогнозирование их биологической активности; были проанализированы ИК-спектры вещества после перекристаллизации с литературными данными, были обработаны полученные результаты, сформулированы выводы.
2. Экспериментальная часть
2.1. Эксперимент
Взаимодействие агидола-3 с фосфористой кислотой в соотношении 1:1.
Сливание и перемешивание растворов 0,41 г (0,005 моля) фосфористой кислоты в 3 мл этилацетата и 1.32 г агидола-3 в 7 мл этилацетата в течение 5 мин вызывают разогревание и обильную кристаллизацию продукта. Реакционную массу выдерживали при комнатной температуре в течение 3 часов. Получено после фильтрования и промывания этилацетатом 1.60 г (91 %) продукта, Т.пл. 161,5–163,0 ˚С. Найдено, %: N 4.12, 4.18; P 9.05,9.17. C17H32O4NP. Вычислен, %: N 4.06; P 8.99.
2.2. Определение температуры плавления агидола-3
В данном методе в качестве реактивов используется анализируемое вещество (агидол-3) и жидкий теплоноситель (концентрированная серная кислота).
Собираем установку: Формируем дно капилляра. Для этого капилляр запаиваем с одного конца, осторожно вращая его в наружной части пламени горелки. Заполняем капилляр агидолом-3. Открытым концом набираем в капилляр немного сухого тонко растертого агидола-3, затем бросаем капилляр запаянным концом с высоты 30–40 см через стеклянную трубку на керамическую плитку несколько раз для уплотнения вещества. Высота уплотненного столбика вещества в капилляре должна быть 5–6мм. Для удобства, чтобы капилляр не сползал в жидкий теплоноситель (H2SO4, конц.), верхний конец капилляра загибаем на небольшом пламени горелки.
Готовый капилляр вставляем в боковой отвод резервуара с теплоносителем так, чтобы конец капилляра с основанием Манниха находился рядом с ртутным шариком термометра.
Для определения ориентировочной температуры плавления нагреваем на пламени горелки прибор с большой скоростью 4–6 градуса в минуту. После начала появления жидкой фазы фиксируем температуру на термометре. Следующее фиксирование температуры происходит, когда полностью исчезает твердая фаза.
Определяем ориентировочный температурный интервал плавления:
ΔТ=т.пл.(кон.),°С-т.пл.(нач.),°С.
Для точного определение температуры плавления производят два измерения – грубое и точное. Далее мы заполняем веществом новый капилляр для точного измерения. При точном определении температуры плавления нагревание ведём с малой скоростью 1–2 градуса в минуту, начиная с температуры на 15–20°С меньшей, чем ориентировочная температура плавления.
Фиксируем начальную и конечную температуру плавления по принципу, описанному выше, и определяем точный температурный интервал плавления
ΔТ=т.пл.(кон.)-т.пл.(нач.),°С.
По полученным экспериментальным результатам делаем заключение о чистоте перекристаллизованного продукта.
Вывод: Таким образом, было доказано, что после перекристаллизации исходного вещества интервал температуры плавления значительно уменьшился и является близким к литературным данным.
2.3. Метод очистки агидола-3 от примесей с помощью перекристаллизации
Готовим горячий насыщенный раствор. В колбу для приготовления раствора помещаем 1 г. Агидола-3,затем добавляем 4 мл. растворителя (Изооктана)
Смесь нагреваем до кипения и далее слабо кипятим до полного или почти полного растворения.
Образование чистого кристаллического продукта происходит при охлаждении горячего насыщенного желтого прозрачного раствора. Для получения крупных кристаллов раствор охлаждают медленно, при быстром охлаждении раствора образуются мелкие кристаллы. Для максимально полного выделения продукта охлаждения осуществляют в бане с холодной водой до комнатной температуры.
Для отделения кристаллов от маточного раствора применяем фильтрование под вакуумом.
Таблица 1
Анализ данных, полученных методом определения температуры плавления
|
Агидол-3 |
Т.пл, °C грубое измерение |
Т.пл, °C точное измерение |
Литературные данные, °С |
|
До перекристаллизации |
98–125 |
92–100 |
93,5 |
|
После перекристаллизации |
90–96 |
93–95 |
Негигроскопичные кристаллические вещества сушим при комнатной температуре в тонком слое в течение нескольких (7–10) дней или в сушильном шкафу при нагревании и перемешивании в течение нескольких (5–6) часов. Продукт взвешиваем и рассчитываем его выход в процентах от исходной массы.
m1 – 100 %; где m1 – масса исходного вещества, г;
m2 – Х % ; где m2 – масса очищенного вещества, г.
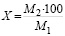 , %;
, %;
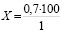 ;
;
X=70 %.
Отсюда можно сделать вывод, что перекристаллизация прошла успешно и выход чистого продукта является хорошим.
2.4. Метод определения растворимости агидола-3 в органических соединениях
Помещаем пробу агидола-3 в пробирку. Наливаем по каплям необходимое количество толуола. Перемешиваем. Агидол-3 начинает растворяется при комнатной температуре. Нагреваем пробирку с пробой. Агидол-3 растворился в толуоле. Оставляем пробу охлаждаться, для выпадения осадка. Спустя сутки агидол-3 почти не выпал в виде осадка. Растворитель не подходит.
Помещаем пробу агидола-3 в пробирку. Наливаем по каплям необходимое количество изооктана. Вещество не растворяется при комнатной температуре. Нагреваем пробирку с пробой. Агидол-3 хорошо растворился в изооктане. Помещаем пробирку в стакан для охлаждения. Выпал осадок оранжевого цвета за короткий промежуток времени. Растворитель подходит.
Таблица 2
Подбор растворителя для агидола-3
|
Растворитель |
При комн. температуре |
При нагревании |
Вывод |
|
Толуол |
Плохо растворяется |
Растворяется, но после охлаждения не выпадает осадок |
Не подходит для перекристаллизации |
|
Изооктан |
Не растворяется |
Растворяется, после охлаждения выпадает осадок |
Подходит для перекристаллизации |
|
Четырех хлористый углерод |
Растворяется |
Не подходит для перекристаллизации |
|
|
Вода дистиллированная |
Не растворяется |
Не растворяется |
Не подходит для перекристаллизации |
Таблица 3
Подбор растворителя продукта реакции агидола-3 с фосфористой кислотой
|
Растворитель |
При комн. температуре |
При нагревании |
Вывод |
|
Толуол |
растворяется |
– |
Не подходит для перекристаллизации |
|
Вода дистиллированная |
растворяется |
– |
Не подходит для перекристаллизации, но удовлетворяет другим требованиям |
|
Этилацетат |
Не растворяется |
Растворяется, после охлаждения выпадает осадок |
Подходит для перекристаллизации |
Вывод. Экспериментальным путем было доказано, что идеальным растворителем для очистки загрязненного основания Манниха, является изооктан. В нем вещество быстро растворяется при нагревании и быстро выпадает в осадок при охлаждении. Продукт реакции агидола-3 с фосфористой кислотой хорошо растворяется в воде, в качестве растворителя для перекристаллизации был подобран этилацетат.
2.5. Метод идентификации вещества с помощью ИК-спектроскопии
Нами был исследован агидол-3 после перекристаллизации с помощью ИК-спетрографа, и получен спектр (рис. 1). Полученный спектр был обработан и сравнен с эталонным ИК-спектром из справочной литературы (рис. 2).
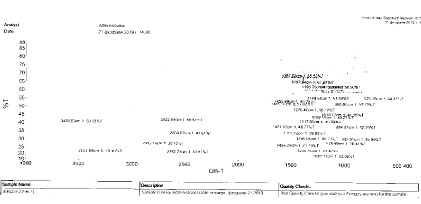
Рис. 1. Полученный ИК-спектр агидола-3
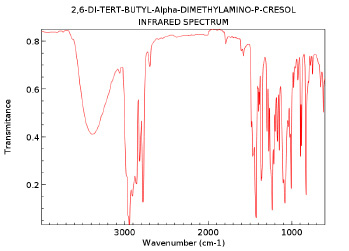
Рис. 2
Сравнив два спектра, мы может утверждать об идентичности их структуры. Отсюда следует, что после перекристаллизации загрязненного агидола-3 мы получили очищенный агидол-3 без примесей.
2.6. Прогноз биологической активности и токсичности агидола-3 с помощью программ PASS и GUSAR
Нами производился прогноз биологической активности по программе PASS [91].
Таблица 4
Часть таблицы, полученной по программе PASS
|
0,880 |
0,008 |
CYP2H substrate |
|
0,870 |
0,007 |
Mucomembranous protector |
|
0,840 |
0,020 |
Ubiquinol-cytochrome-c reductase inhibitor |
|
0,805 |
0,004 |
Reductant |
|
0,797 |
0,001 |
Antimyopathies |
|
0,770 |
0,004 |
CYP2D16 substrate |
|
0,798 |
0,037 |
Membrane integrity agonist |
|
0,797 |
0,037 |
CYP2C12 substrate |
|
0,784 |
0,038 |
Aspulvinone dimethylallyltransferase inhibitor |
|
0,748 |
0,005 |
Trimethylamine-oxide aldolase inhibitor |
|
0,728 |
0,046 |
Testosterone 17beta-dehydrogenase (NADP+) inhibitor |
|
0,704 |
0,028 |
Antiischemic, cerebral |
У агидола-3 с высокой вероятностью (Ра=0.562–0.595) выражена антиоксидантная активность и способность ингибировать процессы пероксидного окисления липидов (Ра=0.505–0.610). По данным прогноза агидол-3 обладает антиишемическими свойствами (Ра=0,740), противоспалительными свойствами (Ра=0,655) ,может быть использован при введении в наркоз, а также при лечении острых неврологических расстройств (0,598), могут проявлять антисептические (0,422) и антипсориазные свойства (0,410), спазмолитик (0,354) и анальгетик (0,385).
С помощью программы GUSAR произведен прогноз токсичности агидола-3.
По данным программ PASS и GUSAR, агидол-3 относится к слаботоксичным, биологически активным веществам. Эти результаты коррелируются с литературными данными и раскрывают дополнительные медико-биологические возможности указанных соединений. Данные прогноза могут быть использованы при планировании дальнейших экспериментальных исследований в системах in vitro и in vivo.
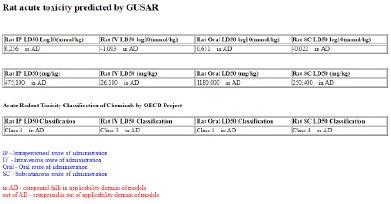
Рис. 3. Прогноз токсичности с помощью программы GUSAR
3. Обсуждение результатов
Способ получения N,N-диметил-(3,5–ди-трет-бутил-4–оксибензил)-амина взаимодействием 2,6–ди-трет-бутилфенола, диметиламина и водного раствора формальдегида при повышенной температуре в органическом растворителе, с целью увеличения конверсии 2,6–ди-трет-бутилфенола и улучшения качества целевого продукта, процесс проводят при 100 – 110oС в присутствии катализатора – четвертичной аммониевой соли формулы [(С4Н9)3С6Н5СН2N] + [OSO2 (ОС2Н5)]- – в количестве 0,03 – 0,16 мас. % по отношению к 2,6–ди-трет-бутилфенолу с использованием в качестве органического растворителя ароматического углеводорода С7 – С9 при отношении его к 2,6–ди-трет-бутилфенолу 1,5 – 1,8 : 1,0 (массовое), причем 2,6–ди-трет-бутилфенол и водный формальдегид подают противотоком [14].
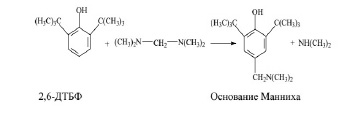
Рис. 4. Реакция получения основания Манниха
Лабораторный метод получения: В колбу с термометром, обратным холодильником, мешалкой загружают 103 г 2,6–ди-трет-бутилфенола, 248 г водного 25 %-го раствора диметиламина и 75 г 37 %-го водного формальдегида, 500 мл этанола и при 75°С перемешивают 3 ч. Затем реакционную массу выливают в холодную воду, выделившиеся кристаллы фильтруют, промывают на фильтре водой и сушат. Всего получают 130,8 г продукта, содержащего 127,9 г основания Манниха (97,78 %) [14].
Особый интерес представляет синтез водорастворимых производных пространственно-затрудненных фенолов, которые будут превосходить по своей эффективности масляные формы ПЗФ. Анализируя работы ученых по изучению антиоксидантной и биологической активности ПФЗ, значимость поиска новых форм водорастворимых фенольных антиоксидантов достаточно актуальна в современном мире.
В последнее десятилетие широкое распространение получили фосфорсодержащие органические комплексообразующие агенты, к ним относится и фосфористая кислота [8].
В связи с вышесказанным, для синтеза водорастворимых солей аминов пространственно затрудненных фенолов нами были использованы 3,5–ди-трет-бутил-4–гидроксибензилдиметиламин или основание Манниха и фосфористая кислота.
Найдено, что состав и строение продуктов реакции агидола-3 с фосфористой кислотой зависят от молярного соотношения реагентов. Показано, что реакции вышеуказанного основания Манниха с двумя эквивалентами фосфористой кислоты относительно атома азота в состав основания Манниха при прямом взаимодействии реагентов или в присутствии растворителей (этилацетата, диэтилового эфира) приводят к образованию солеобразных продуктов супрамолекулярной структуры состава основания Манниха∙2H3PO3. Реакции протекают при комнатной температуре с заметным экзотермическим эффектом [9].
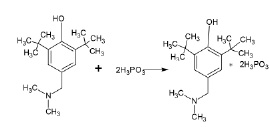
Формула 1
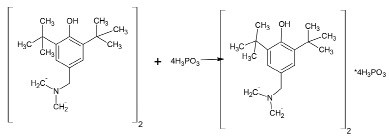
Формула 2
Взаимодействие фосфористой кислоты с агидолом-3 приводит к образованию продукта состава ФОМ-1∙2H3PO3 в интервале температур 20–120˚С при использовании как стехиометрического соотношения реагентов 1:2, так и при соотношении реагентов 1:3.
Выход продуктов (формула 1–2) составляют 65–85 %, их состав и строение подтверждены данными элементного анализа и спектральными характеристиками.
Синтезированные соединения, различающиеся строением пара-алкильного заместителя, образуют структурный ряд, открывающий определенные перспективы исследования взаимосвязи строения продуктов с их антиоксидантными свойствам и биологической активностью.
Данные соединения характеризуются высокой растворимостью в воде в соотношении 1:4–1:5. Однако при приготовлении более концентрированных (1:2–1:3) водных растворов соединения через 1–2 минуты после полного растворения происходит выпадение кристаллов игольчатой формы. Определение состава образовавшегося продукта показывает, что соединение теряет одну молекулу фосфористой кислоты с образованием соли состава ФОМ-1∙H3PO3 с выходом 54 %.
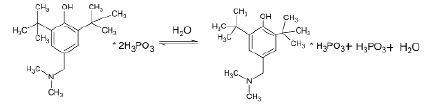
Формула 3
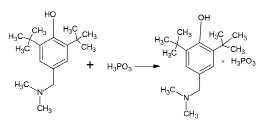
Формула-4
Заключение
Поиск биологически активных водорастворимых соединений является актуальной задачей современной науки. Данные исследования проводятся во многих научных центрах, в том числе КНИТУ.
Пространственно-затрудненные фенолы хорошо известны как антиоксиданты и биологически активные вещества. В ходе данной научно-исследовательской работы нами произведен литературный анализ биологической активности соединений класса пространственно-затрудненных фенолов, был получен агидол-3 и его водорастовримая соль. С помощью компьютерных программ был выполнен прогноз биологической активности и токсичности исследуемого соединения.
Библиографическая ссылка
Филиппова М.И., Товкалева Е.В. ВОДОРАСТВОРИМЫЕ БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА КЛАССА ПРОСТРАНСТВЕННО-ЗАТРУДНЕННЫХ ФЕНОЛОВ // Международный школьный научный вестник. 2019. № 5-1. ;URL: https://school-herald.ru/ru/article/view?id=1157 (дата обращения: 08.01.2026).
