Введение
Любая наука имеет свою историю, свой путь развития. Это относится и к химии, одной из сложнейших и интереснейших наук. Человечество всегда интересовалось чем-то мистическим, загадочным, неизведанным. Такая наука, как алхимия возникла очень давно, но интерес к ней не пропал и по сей день. И в нынешнее время многие люди задаются вопросом, что такое алхимия.
Проблема: неправильное восприятие образа алхимика в современном мире. Актуальность проблемы заключается в том, что во многих художественных произведениях приводится стереотипный, заведомо ложный образ алхимика, не имеющий каких-либо реальных исторических подтверждений.
Цель работы:
Изучить историю алхимии и выяснить ее роль в становлении химии.
Задачи работы:
1. Изучить историю алхимии.
2. Выявить основные принципы и законы алхимии.
3. Познакомиться с алхимическими символами, лабораторией алхимика, известными алхимиками.
4. Определить практическую пользу исследований алхимиков.
5. Провести химические превращения, основанные на алхимии.
6. Проанализировать полученные результаты.
Литературный обзор.
В качестве источников информации был изучен ряд книг, включающий в себя как школьную программу, так и дополнительную естественно-научную литературу. Не стоит и уменьшать вклад интернета, так как на основе данных, найденных в интернете, строится часть текста.
Алхимия – донаучное направление химии
В истории химии можно выделить следующие основные этапы её развития:
1. Предалхимический период: до III в. н. э. В предалхимическом периоде теоретический и практический аспекты знаний о веществе развивались относительно независимо друг от друга. Происхождение свойств вещества рассматривала античная натурфилософия, практические операции с веществом являлись прерогативой ремесленной химии. Однако начало зарождения ремесленной химии следует в первую очередь связывать с появлением и развитием металлургии. В истории Древнего мира традиционно выделяются Медный, Бронзовый и Железный века, в которых основным материалом для изготовления орудий труда и оружия являлись соответственно медь, бронза и железо. [3]
2. Алхимический период: III – XVI вв. Со времени бессмертного Гермеса алхимики утверждали, что они могут получать золото из олова, серебра, свинца и ртути. Трудно представить, что созвездие блистательных умов, на протяжении более 2,5 тыс. лет демонстрировали здравый смысл и рациональный подход к множеству проблем философии, науки, полностью заблуждались в вопросе превращения металлов. Императоры, знать, священники и простолюдины были свидетелями реальных чудес превращения металлов. Существуют легенды, что царь Соломон и Пифагор были алхимиками, что первый их них получал алхимическими средствами золото для украшения своего Храма.Халдеи, финикийцы и вавилоняне, как и многие древние восточные народы, были знакомы с принципами алхимии, которая практиковалась в Греции и Риме и была высшей из наук в Египте.
Алхимики существовали еще в Древнем Китае, и не только в исторический, императорский период. Они были уже в мифические времена, в эпоху первочеловека Паньгу, в эпохи Небесных императоров и легендарных Владык, которые принесли на землю чудесную тайну — Огонь. Алхимия существовала и в Индии. Она также имела магико-практический характер, но не сводилась к изучению металлов, как в братствах Древнего Китая. Разве могли не знать об алхимии необыкновенные ученые Древнего Египта, которые удивляли своих современников и до сих пор поражают нас? Египтяне должны были знать многое о природе камней и металлов, человека и Вселенной, чтобы — вот лишь несколько примеров — устанавливать камни пирамид один на другой без соединительного раствора; чтобы делать измерения без соответствующих инструментов (так, по крайней мере, пишут в книгах) и обрабатывать диорит медными орудиями (присутствие следов меди показывает радиоуглеродный анализ), что сравнимо с резьбой по дереву бумажным ножом. Нам придется допустить, что египтяне знали формулы, условия и методы изменения свойств природных тел.
Много позднее, в начале I века нашей эры арабы-химики ввели вместо названия «химия» другое — «алхимия». Полагают, что это слово ближе к понятию «благородная химия», так как алхимию считали «искусством превращения неблагородных металлов (железа, свинца, меди) в благородные» — золото и серебро с помощью особого вещества — «философского камня». Считается, что первым человеком, поведавшем миру о философском камне, был египтянин Гермес (Меркурий) Трисмегист (Hermes Trismegistus) — «Гермес Триждывеличайший». Его представляли то, как сверхъестественное существо, то, как историческое лицо, жившее, по одной из версий, с 1399 по 1257 год до н.э. Гермеса Трисмегиста также называют первым алхимиком, получившим философский камень. Рецепт изготовления философского камня был записан в его книгах, а также на т. н. «Изумрудной скрижали Гермеса» — табличке из его гробницы в долине Гебра (по преданию, её нашли воины Александра Македонского), на которой было высечено тринадцать наставлений потомкам.
Цели алхимии
Целью алхимии была великая трансформация, великое открытие, великое превращение. Первая цель — это поиск способа получить золото из менее благородных металлов, чтобы обогатиться и в конечном итоге обрести власть. Другая цель этой науки — достижение бессмертия. И третья цель алхимии — достижение счастья.
Чем алхимические явления отличаются от физических и химических?
Чтобы увидеть, что такое алхимическое явление, предположим, что мы взяли атом водорода и с помощью приемов, свойственных алхимии, осуществили его внутреннее изменение, преобразование, в результате которого атом водорода превратился в атом другого элемента. В наше время этот процесс известен как ядерная или атомная реакция, мы называем его расщеплением атома. Но на самом деле это алхимический феномен. В этих трансмутациях есть глубокий смысл. Он связан с принципом Эволюции: все существующее в природе, во Вселенной движется, развивается, стремится к чему-то, имеет цель и предназначение — и камни, и растения, и животные, и люди.
Целью алхимических экспериментов был поиск того, что могло бы улучшить, ускорить рост, помочь эволюции. Ведь то, что когда-нибудь станет золотом, может быть золотом уже сегодня, поскольку это и есть его истинная суть. А то, что в человеке когда-нибудь станет бессмертным, может быть бессмертным уже сегодня, поскольку это истинная суть человека. То, что когда-нибудь станет совершенным, может быть совершенным уже сейчас. И если есть способ сделать это за минуты, то зачем тратить на это часы? Таким образом, алхимик, если он хорошо применяет свою науку и философию, превращается в истинного благодетеля для природы, которой он помогает быстрее развиваться.
«Триумфальная колесница антимония», «О великом камне древних мудрецов», «Последнее завещание», «Раскрытие тайных приемов», «Трактат о естественных и сверхъестественных предметах металлов и минералов», «О микрокосме», «О тайной философии» приводит новые сведения о различных веществах, их свойствах и способах получения, в том числе впервые упоминает о соляной кислоте, даёт подробное описание сурьмы и её соединений.
Алхимические знаки, символы, элементы [1]
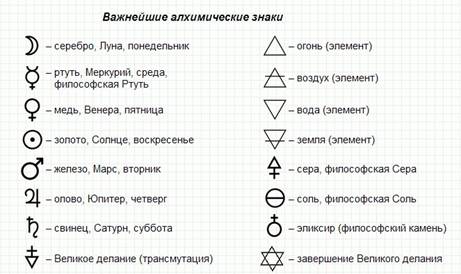 .
.
Лаборатория алхимика
Алхимик обычно обладал весьма скромным набором приборов и инструментов. Особо следует отметить поразительное постоянство весьма незамысловатой технологии алхимиков: с начала и до конца средних веков и даже в более поздние времена всегда использовались одни и те же предметы, применявшиеся в свое время еще арабами, а до них — греческими алхимиками Александрии. Название пеликан, данное перегонному аппарату, использовавшемуся средневековыми алхимиками, навеяно самой его формой, напоминающей характерные контуры клюва и шеи этой птицы. Раймонд Луллий продолжает свое описание: «…Аламбик представляет собой два сосуда одинаковой величины, емкости и высоты, соединенные друг с другом таким образом, чтобы нос одного входил внутрь другого, с тем чтобы содержимое того и другого под действием тепла поднималось вверх, а затем, в результате охлаждения, опускалось вниз».Великое Делание должно было совершаться или в печи, или в тигле. Алхимическая печь, имевшая название атанор, топилась дровами или растительным маслом (наличие множества фитилей позволяло регулировать интенсивность нагревания), ибо настоящие алхимики никогда не использовали уголь. Атанор иногда имел форму башни. Имелись также различные резервуары и сосуды для приемки использованных веществ, приспособления для дистилляции, щипцы, кочерга и молотки, мехи, служившие, для раздувания огня. Длюдель представлял собой колпак перегонного куба (аламбика), но чаще это слово использовалось для обозначения философского яйца (стеклянной или хрустальной реторты). Алхимики использовали сосуды и посуду, аналогичные тем, что применялись ремесленниками их эпохи, — керамические и стеклянные. Тигли, использовавшиеся алхимиками, работавшими по методу сухого пути, имели полость в форме креста (по-французски croix, откуда происходит древнее название тигля-crucible). [1]
Множество полезных открытий
Порох монахов Р. Бэкона и Б. Шварца, сурьма Василия Валентина, фосфор X. Бранда , фарфор И. Беттгера, новые вещества— серная, соляная и азотная кислоты, царская водка, аммиак, поташ, щелочи, соединения ртути, серы, свинца, сурьмы, оксиды металлов, винный спирт, уксусная кислота, ацетон, эфир, берлинская лазурь, открытие взаимодействия кислоты и щелочи (реакция нейтрализации), конструирование стеклянных и металлических приборов, многие из которых и поныне оснащают химические лаборатории, — все это и составило экспериментальную основу научной химии. В России алхимия не получила развития. Петр I принимал все научные предложения, кроме алхимических, так как считал, что «изготовители золота» либо обманщики, либо невежды. Он предпочитал богатство государства строить на основе точного знания, в том числе и химического. Когда Петр путешествовал по Европе, то посетил и самого знаменитого химика тех времен Г. Бургаве (1668 1738). А знаменит он был, в частности, тем, что не верил в теории алхимиков и называл химию «наукой эмпирической», т. е. основанной на опыте.Действительно, практическая деятельность в XV- XVII вв. была лучшим источником для накопления надежных опытных знаний. Появились и химические лаборатории у Андреаса Либавия, у химика-самоучки Р. Глаубера. Глаубер впервые сумел получить множество чистых химических веществ.
В XVII веке эмпирическим путем был открыт секрет производства фарфора, столь ревностно хранившийся китайцами на протяжении столетий. [5]
Практическая часть
«Трансмутация» металла. Железо трансмутируется в медь.
Многовековой опыт алхимиков свидетельствовал: все металлы при нагревании плавятся и становятся похожими на жидкую подвижную блестящую ртуть. Значит, все они - из ртути. Железный гвоздь краснеет, если опустить его в водный раствор медного купороса. Это явление объясняли в алхимическом духе: железо трансмутируется в медь. Изменяются отношения двух начал в металлах. Изменяется и их цвет. (Мы теперь хорошо знаем, что медь, вытесненная железом из раствора медного купороса, оседает на поверхности гвоздя.)
CuSO4 + Fe → FeSO4 + Cu↓
То, что арабский алхимик Джабир аль-Хайян на рубеже I и II тысячелетий называл «превращением железа в медь», на самом деле было процессом, очень похожим на рассмотренный опыт. В растворе медного купороса железные клинки покрывались слоем меди, выделившейся по реакции (Приложение 1).
«Замшелые камни»
На дно широкого стеклянного сосуда с достаточно толстыми стенками опустимгальку. Затем наливаем на половину объёма сосуда концентрированный раствор сульфата меди (II) CuSO4. После этого в раствор добавляем смесь цинковой пыли и гранулированного цинка до исчезновения голубой окраски раствора.Частицы цинка покрываются лохматым налетом кирпично-красного цвета, похожим на мох, и оседают на камнях. Это говорит о выделении меди в результате окислительно-восстановительной реакции:
CuSO4 + Zn → ZnSO4 + Cu↓ (Приложение 2)
Вот как описывает металлы Р. Бэкон: золото –тело совершенное, серебро — почти совершенное, но ему недостает только немного веса, постоянства и цвета. Олово немного недопечено и недоварено. Свинец еще более нечист, ему недостает прочности, цвета, он недостаточно проварен. В меди слишком много землистых негорючих частиц и нечистого цвета. Как следует из этого описания, каждый металл болен (а раз болен, то, значит, живой). Причем определена болезнь и, стало быть, указано, в каком направлении лечить — прибавить в весе, допечь, доварить, придать прочность, углубить окраску, проварить, прояснить цвет, отнять землистые негорючие частицы, выжечь нечистую серу и тогда золото, уже содержащееся в каждом металле, явится в совершенном своем блеске. Например, олово — еще «не преображенное» золото. Его можно чудодейственно преобразить с помощью конкретных лабораторных процедур. Разумеется, это ничего общего с наукой не имеет. Зато именно на этом пути (вещество и его свойства не отвергнуты, а приняты во внимание) накапливается богатый опытный материал— описания веществ, подробности их превращений.
Аллотропия или трансмутация.
Алхимики не научились делать золото, не нашли философского камня, но зато собрали много ценных фактов о превращении тел. Переход от одной "модификации" к другой и есть истинная трансмутация элементов, различие только в том, что так называемые "аллотропные модификации элементов" незначительно отличаются по количеству содержащейся в них энергии, следовательно, их сравнительно легко превратить один в другой. Изготовление кристаллических решеток белого, черного и красного фосфора.
Горение серы
Алхимия - не наука, не искусство, не философия, но и то, и другое, и третье. С Солнцем связана философская сера – сульфур, это чистый огонь, взрывное начало. Символ, обозначающий серу, светится, говоря образно, синеватым серным пламенем и дышит едким удушливым дымом горящей серы. Ведь треугольник, обращенный острием вверх, — это знак огня. А крест — свидетельство нечистоты серы, а значит, и ее горючести. Современный символ серы для того, не знает основных понятий химии, лишь значок – первая буква латинского слова sulfur (сера). (Конечно, в свете периодического закона Менделеева и его таблицы элементов за символом S стоит очень многое).
Горение серы в кислороде
В колбу с пероксидом водорода добавим немного катализатора – оксида марганца (IV), МnO2. В колбе бурно происходит реакция: 2Н2О2 = 2H2O + O2↑.Заполним колбу кислородом. Внесем в пробирку тлеющую лучинку. Она загорелась ярким пламенем, что говорит о наличии кислорода в колбе. Добавим немного перекиси водорода. Кислород активно взаимодействует с горючими веществами, например, с серой (S). Желтый порошок серы помещаем в ложку для сжигания веществ и разогреваем на пламени спиртовки. Сера горит. Но на воздухе горение почти незаметно. Опустим горящую серу в колбу с кислородом – окисление серы становится интенсивным. Сера горит ярким синим пламенем; при горении образуется сернистый газ SO2: S + O2= SO2 (Приложение 3)
Сера - мистическое вещество. В древности ее использовали для совершения обрядов. Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное применение. Куски самородной серы использовались для совершения обряда изгнания злых духов. Так, по легенде, Одиссей, возвратившись в родной дом после долгих странствий, первым делом велел окурить его серой. Техника безопасности. Опыт следует проводить под тягой. Следует соблюдать правила обращения с нагревательными приборами. Не допускать попадания горящей серы на рабочую поверхность стола. Не вдыхать выделяющийся сернистый газ.
Взаимодействие серы с металлами
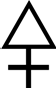
Сера – типичный активный неметалл. Она реагирует с простыми и сложными веществами. В химических реакциях сера может быть, как окислителем, так и восстановителем. Это зависит от окислительно-восстановительных свойств веществ, с которыми она реагирует. Сера проявляет свойства окислителя при взаимодействии с простыми веществами – восстановителями (металлами). Алхимики считали, что «металлические свойства» веществам придает ртуть, а «неметаллические свойства» — сера:
Злато, олово, свинец, —
Сын мой, сера их отец.
И спеши, мой сын, узнать —
Всем им ртуть родная мать.
Получение сульфида железа (II). [2] Взяли заранее приготовленную смесь из 7 г порошка железа с 4 г серы (массовое отношение рассчитали по химическому уравнению). В прямую стеклянную трубку поместили столько смеси, чтобы она заняла пространство около одного сантиметра. Нагрели смесь с одного края. Как только нагреваемый участок смеси накалился, отняли трубку от огня. Наблюдали как накал распространяется по всей смеси. Уравнение реакции: Fe + S = FeS +23,1 ккал. Благодаря выделению большого количества тепла начавшаяся реакция продолжается без подогревания извне. Когда закончилась реакция, вытолкнули стеклянной палочкой из трубки на стекло продукт реакции. На продукт поместили несколько капель раствора соляной кислоты. Почувствовали неприятный запах сероводорода (запах тухлых яиц). Уравнение реакции: FeS + 2HCl = FeCl2 + H2S↑ (Приложение 4)
Получение сульфида цинка. [2] Взяли заранее приготовленную смесь из 6 г порошка цинка с 3 г серы. В прямую стеклянную трубку поместили немного смеси и осторожно нагрели. Реакция протекает по уравнению Zn + S = ZnS + 41,3 ккал. Происходит лёгкая вспышка; реакция протекает с выделением большого количества энергии. При проведении опыта нельзя наклоняться над смесью серы с цинком и нельзя проделывать опыт в пробирке. Образующийся сульфид цинка в виде белого налёта оседает на стенках трубки. Опыт следует проводить под тягой. Когда закончилась реакция, вытолкнули стеклянной палочкой из трубки на стекло продукт реакции. На продукт поместили несколько капель раствора соляной кислоты. Почувствовали неприятный запах сероводорода (запах тухлых яиц). Уравнение реакции: ZnS + 2HCl = ZnCl2 + H2S↑ (Приложение 5)
Получение сульфида алюминия. [2] Взяли заранее приготовленную смесь из 3 г порошка алюминия с 5 г серы. В прямую стеклянную трубку поместили немного смеси и осторожно нагрели.
Реакция протекает по уравнению 2Аl + 3S=Аl2S3+126 ккал. В этом случае также происходит вспышка и образуется белый сульфид алюминия. Для проверки свойств образовавшегося сульфида действуем на него разбавленной соляной кислотой. Почувствовали неприятный запах сероводорода (запах тухлых яиц).
Уравнение реакции: Al2S3+6HCl= 2AlCl3 +H2S↑ (Приложение 6)
Продукт оазиса Амона [4]
Аммиак NН3 — бесцветный горючий газ с резким запахом — был известен еще в Древнем Египте за 1500 — 1000 лет до н. э. Египетские жрецы добывали его из «нашатыря» (хлорида аммония NH4Cl). Для его получения сажа, осаждающаяся в дымоходах печей, отапливаемых верблюжьим навозом, подвергалась возгонке в ретортах. Образующиеся бесцветные кристаллы арабы называли «нушадир». Нашатырь был также природным продуктом разложения мочи и испражнений верблюдов и других животных в оазисе Аммона, через который проходили многочисленные караваны. По имени этого оазиса и стали позднее называть такие вещества, как аммиак и соли аммония. Выделяли аммиак, нагревая хлорид аммония NH4Cl с гидроксидом кальция Са(ОН)2:
2NH4Cl + Ca(ОН)2 = 2NН3↑+ CaCl2 + 2H2O (Приложение 7)
По другим сведениям, аммиак получил свое название от древне–египетского слова «аммониан». Так называли поклоняющихся богу Аммону. В своих ритуальных обрядов они нюхали нашатырь, который имеет запах аммиака.
«Химическая радуга» [4]
Цвет, обладающий глубоким информационно-энергетическим потенциалом, играл огромную роль в алхимии – специфической области натурфилософии. Каждой стадии алхимического процесса соответствовала определенная цветовая окраска. В алхимии была разработана четкая система соответствий металлов, цветов и планет. Так, Сатурну соответствовал свинец и черный цвет, Луне – серебро и белый цвет, Венере – медь и красный, Марсу – железо и ирис. Черный и белый цвета в алхимических практиках сопутствуют друг другу. От черного, через белый и другие промежуточные цветовые оттенки к красному – цель алхимиков, потому что только с этим цветом в алхимии связано получение, рождение философского камня.
Цветная радуга в пробирках. Для получения цветов радуги в разных пробирках сливаем попарно растворы. В 1-й пробирке - хлорид железа (III) и роданид калия (красный цвет): FeCl3 + 3KCNS = Fe(CNS)3↓ + 3KCl. Во 2-й пробирке - раствор хромата калия подкисляем H2SO4 (оранжевый цвет): 2К2CrO4 + Н2SO4 = К2Cr2O7 + К2SO4 + Н2О. В 3-й пробирке - нитрат свинца (II) и иодид калия (желтый цвет): Pb(NO3)2 + 2KI = PbI2↓ + 2KNO3. В 4-й пробирке - сульфат никеля (II) и гидроксид натрия (зеленый цвет): NiSO4 + 2NaOH = Ni(OH)2↓ + Na2SO4. В 5-й пробирке -сульфат меди (II) и гидроксид натрия (голубой цвет): CuSO4 + 2NaOH = Cu(OH)2↓+ 2Na2SO4. В 6-й пробирке - сульфат меди (II) и раствор аммиака (синий цвет): CuSO4 + 4NH3 = [Cu(NH3)4]SO4. В 7-й пробирке - хлорид кобальта (II) и гидроксид натрия. Наблюдаем появление синего осадка гидроксида-хлорида кобальта(II):
CoCl2 + NaOH = CoCl(OH)↓ + NaCl
Продолжая перемешивание, добавляем новые порции раствора гидроксида натрия до получения розового гидроксида кобальта(II) состава Co(OH)2:
CoCl(OH) + NaOH = Co(OH)2↓+ NaCl.
Опыт очень эффективный, благодаря яркости веществ, получаемых в ходе реакции. (Приложение 8).
Заключение
Многие уверены в том, что алхимия наукой не является, а занимались ею исключительно мошенники и искренне заблуждающиеся люди. Выполнив работу, мы убедились, что это не совсем так. Главным результатом алхимического периода, помимо накопления значительного запаса знаний о веществе, стало становление эмпирического (опытного) подхода к изучению свойств вещества. В целом алхимический период явился совершенно необходимым переходным этапом между натурфилософией и экспериментальным естествознанием. Мы окунулись в волшебный мир химических превращений, провели интересные опыты, основанные на алхимии. С древних времени до наших дней люди стремятся отыскать ключи к замкам, за которыми природа хранит свои тайны. Мы тоже попытались проникнуть в этот мир, вооружившись современными знаниями. Вокруг нас очень много интересного: кажется, что вещества живут своей, особой таинственной жизнью. Для того, чтобы это интересное увидеть и суметь объяснить, нужны химический кругозор и эрудиция, которые нам необходимо постоянно пополнять
Приложения
Приложение 1: «Железо трансмутируется в медь»



Приложение 2: «Замшелые камни»



Приложение 3: «Горение серы»



Приложение 4: «Получение сульфида железа (II)»



Приложение 5: «Получение сульфида цинка»


Приложение 6: «Получение сульфида алюминия»


Приложение 7: «Продукт оазиса Амона»


Приложение 8: «Химическая радуга»


Библиографическая ссылка
Буланкина А.А., Кийко Д.Ю. АЛХИМИЯ - ВЕНЕЦ СРЕДНЕВЕКОВОЙ УЧЕНОСТИ // Международный школьный научный вестник. 2020. № 2. ;URL: https://school-herald.ru/ru/article/view?id=1297 (дата обращения: 28.12.2025).
