За время существования человечества в природную среду было введено около миллиона новых веществ (всего известно свыше 6 млн химических соединений) . Ежегодно в мире синтезируется около 250 тысяч новых химических соединений, многие из которых получают широкое применение и могут поступать в окружающую среду. В практике используется 500 тысяч химических соединений, из них по оценке международных экологических организаций, около 40 тысяч обладают вредными для человека свойствами, а 12 тысяч являются токсичными.
Вредные химические элементы и вещества попадают в водоемы, ухудшая их санитарное состояние и вызывая необходимость специальной глубокой очистки воды перед использованием ее для хозяйственно-питьевых и некоторых промышленных целей
Многие примеси не извлекаются из воды механически, не нейтрализуются при биологической очистке, не удаляются такими традиционными методами водоочистки, как отстаивание, коагуляция и флотация.
Основные загрязнители водных сред
Различают природную, сточную и денатурированную воду. Природная вода – это вода, которая качественно и количественно формируется под влиянием естественных процессов при отсутствии антропогенного воздействия и качественные показатели которой находятся на естественном среднемноголетнем уровне. Сточная вода – это вода, бывшая в бытовом, производственном или сельскохозяйственном употреблении, а также прошедшая через какую-либо загрязненную территорию, в том числе населенного пункта. Природная вода, подвергаемая антропогенному загрязнению, например, путем смешения со сточной водой, называется денатурированной или природно-антропогенной.
При употреблении загрязненных воды, молока и пищи радиоизотопы легко проникают в клетки организма, накапливаются в нем и, излучая мощные a -, b – или g -лучи, поражают организм, вызывают лейкемию, рак, генетические повреждения клеток. Например, радиоактивные уран, торий и радий, излучающие тяжелые a -частицы, очень легко разрушают молекулы ДНК в ядрах клеток и поэтому считаются наиболее токсичными из всех радиоактивных элементов.
Изотоп 131I концентрируется в щитовидной железе и, излучая b -лучи, поражает ее. Изотоп 90Sr и его дочерний радиоактивный продукт 90Y накапливаются в клетках костного мозга и разрушают их, 137Cs легко проникает в клетки тела, приводя к довольно равномерному облучению всего организма.
К содержанию радиоизотопов в воде водоемов предъявляются чрезвычайно жесткие требования. Например, для 90Sr в воде ПДК = 3Ч 10-11 Ки/л, или в пересчете на массовые единицы 1.5Ч 10-10 мг/л. ПДК других радиоактивных изотопов находятся в пределах 10-8-10-11 Ки/л.
Сброс в водоемы сточных вод, содержащих радиоактивные вещества, совершенно не допустим.
Радиоактивное загрязнение среды обуславливается по сути дела химическим загрязнением, т.е. проникновением в среду продуктов деления атомного ядра. Кроме радиоактивного загрязнения выделяют следующие виды химических загрязнителей воды:
1) биологически нестойкие органические соединения;
2) малотоксичные неорганические соли;
3) нефтепродукты;
4) биогенные соединения;
5) вещества со специфическими токсическими свойствами, в том числе тяжелые металлы, биологически жесткие (неразлагающиеся) органические синтетические соединения.
Очистка воды от этих загрязнителей невозможна без знания их поведения в водной среде.
Поведение химических загрязнителей в воде
Органические загрязнители
Десятки миллионов тонн органических соединений, в том числе миллионы тонн ПАВ, ежегодно поступают в атмосферу и водоемы из многочисленных и разнообразных источников (испарение, потери и неполное сгорание химического органического топлива, городские и промышленные жидкие, твердые и газообразные отходы и т.д.) . В окружающей среде они подвергаются воздействию различных физико-химических и биологических агентов. Многие из них распадаются за сравнительно короткий срок (10-100 дней) с образованием промежуточных продуктов, в том числе метаболитов – продуктов обмена веществ в живых организмах, вплоть до полной минерализации. В ряде случаев промежуточные продукты разложения органических соединений оказываются более токсичными загрязнителями, чем исходные вещества, и система подвергается вторичному химическому загрязнению.
Особую опасность представляют биологически стойкие трудноокисляемые органические соединения. Они способны накапливаться в окружающей среде и в течение длительного времени оказывать токсическое воздействие на живые организмы (эффект долгосрочного действия).
Пестициды
Ежегодно в окружающую среду вводится 2 млн т пестицидов (хлорорганические и фосфорорганические соединения, производные карбаматов, хлорфенксикислот). Даже очень малые концентрации пестицидов токсичны и придают воде неприятные привкусы и запахи. Многие из них разрушаются очень медленно (иногда в течение нескольких лет). Часто продукты распада пестицидов достаточно стойки и также могут оказывать токсическое действие.
Поскольку значительная часть стойких загрязнителей поступает в водоемы с промышленными, сельскохозяйственными и бытовыми сточными водами, то очистка и повторное использование этих вод имеют большое экологическое значение и осуществляются во многих странах. В связи с малыми концентрациями стойких органических веществ в сточных водах и их преобладающей олеофильностью наибольшее применение находят методы очистки, основанные на сорбции на природных ионитах (глинистые минералы и цеолиты), синтетических макропористых ионитах и активных углях.
Нефтепродукты
Особую группу химических загрязнителей составляют нефтепродукты. Общая масса нефтепродуктов, попадающих ежегодно в моря и океаны, оценивается по данным американских ученых в 6.1 млн т, из них 2.1 млн т составляют потери при транспортировании нефти, 1.9 млн т выносится реками, остальное поступает с городскими и промышленными отходами прибрежных районов и из природных источников.
Степень воздействия нефтепродуктов на водную среду определяется прежде всего их составом. В высокомолекулярных фракциях нефти содержится до 5 % серы, 1 % азота и кислорода, а также различные комплексообразущие металлы. В водной среде нефтепродукты образуют пленку, которая взаимодействует с естественной поверхностной пленкой, увеличивая ее толщину и образуя квазиравновесную систему. Одна тонна нефти может растекаться и покрыть поверхность воды, равную 20 км2, в течение 6-7 суток. До 25 % от общей массы (легколетучие компоненты) испаряется за несколько дней. Тяжелые фракции оседают на дно водоема, изменяя биологические особенности среды обитания.
Тяжелые металлы
К стойким химическим загрязнителям кумулятивного действия со специфическими токсическими свойствами относятся и тяжелые металлы. Тройку наиболее экологически опасных тяжелых металлов составляют свинец, ртуть и кадмий. Более 35 видов металлов извлекается в составе руд и химического топлива из недр Земли на ее поверхность.
В процессе переработки руд, сжигания энергоносителей, потребления тяжелых металлов огромные их количества поступают в атмосферу и водоемы в виде отходов.
Например, в Мировой океан из атмосферы ежегодно поступает 200 тыс. т свинца. А антропогенное накопление ртути в биосфере (главным образом в гидросфере) к настоящему времени оценивается в 1 млн т. Потери кадмия в биосферу составляет 5 тыс. т/год.
Поступая в водную среду, тяжелые металлы вступают во взаимодействие с другими компонентами среды, образуя гидратированные ионы, оксигидраты, ионные пары, комплексные неорганические и органические соединения. Конкретная форма существования металлов зависит от их природы, природы ионов и молекул, конкурирующих за место лиганда, pH, температуры и ионности среды.
Многие тяжелые металлы образуют так называемые синергетические смеси, которые оказывают на водные организмы токсическое воздействие, значительно превышающее сумму действий отдельных компонентов.
Поведение тяжелых металлов в реальных средах сложно и малоисследовано. Вместе с тем их накопление в живой природе вызывает серьезное беспокойство во всем мире. Поэтому поступление тяжелых металлов в атмосферу, водоемы и на земледельческие поля должно быть приостановлено и взято под строгий контроль. Все источники тяжелых металлов могут быть ликвидированы путем организации на предприятиях систем очистки и повторного использования сточных вод.
Биогенные вещества
Особую опасность представляют соединения азота и фосфора, в больших количествах попадающие в водоемы с бытовыми промышленными сточными водами, из атмосферы (оксиды азота), а также вследствие вымывания минеральных и органических удобрений из почвы. В Результате смыва удобрений в водоемы мира ежегодно поступает от 3 до 6 млн т P2O5.
Попадая в водоемы, биогенные элементы стимулируют развитие сине-зеленых водорослей. Происходит эвтрофикация (цветение) водоемов. Вследствие массового гниения водорослей в воде появляются сероводород, меркаптаны, фенолы и другие токсичные продукы, исчезает кислород, вода становится мертвой.
Неорганические соли
Отдельную группу химических загрязнителей составляют неорганические соли. Несмотря на малую токсичность многих растворимых солей, все возрастающее накопление их в природных пресных водах вызывает ряд серьезных экономических и экологических проблем: увеличение затрат на водоподготовку на электростанциях и промышленных предприятиях, уменьшение запасов пресной воды, пригодной для полива сельскохозяйственных угодий, ухудшение условий нереста рыб, ухудшение качества питьевой воды и т.д. Основными источниками поступления солей в водоемы являются дренажные сельскохозяйственные воды, промышленные сточные воды, в том числе продувочные воды систем водоснабжения, регенерационные растворы и промывные воды установок водоподготовки электростанций и др. В связи с этим опреснение дренажных вод, обессоливание продувочных, поверхностных, промывных, рудничных и других сточных вод в промышленности, создание бессточных схем водоподготовки и замкнутых водооборотных систем с обессоливанием подпиточной воды являются эффективными решениями данной проблемы, в реализации которых главная роль принадлежит ионному обмену и электродиализу.
Цели и задачи исследования
Мы, школьники р.п. Мухтолово, исходя их того, что находящиеся на территории поселка пруды имеют большое значение для населения, проводили наблюдение за их состоянием.
Целью работы было оценить экологическое состояние 2-х прудов р.п.Мухтолово.
Для решения этой цели осуществили следующие задачи:
1. Изучение некоторых физических и химических показателей воды исследуемых водоемов.
2. Выявление возможных причин загрязнения прудов.
3. Разработка мер по очистке воды и охране прудов.
Общие сведения о прудах
Пруд – водоем в естественном или выкопанном углублении, а также запруженное место в реке. Это искусственный водоем, выкопанный до глубины 3-5 метров или созданный путем постройки плотины в долинах небольших рек, ручьев, на территории балок или оврагов. Обычно пруд представляет собой водоем площадью не более 1 кв.км, который должен иметь достаточной крутизны берега, слабый уклон дна и устойчивое к размыву ложе. Если питание будет происходить за счет стока речных или грунтовых вод, то заполнение пруда рассчитывают только на талые весенние воды. Для удаления избытка воды иногда устраивают водоспуски. В сельской местности пруды создаются с целью орошения, обводнения, разведения рыбы, водоплавающей птицы, а также хранения воды для различных хозяйственных целей. В городах и зонах отдыха пруды являются местами рыбной ловли, купания и проведения различных спортивных мероприятий.
Пруды р.п. Мухтолово как объекты экологического исследования
Характеристика исследуемых прудов
Для исследования состояния воды мы выбрали два пруда, находящихся на территории р.п. Мухтолово.
1-й пруд находится почти в центре посёлка в парковой зоне. Он состоит из двух водоёмов, соединённых между собой узким перешейком. Длина его 160 м; ширина – 11 м; глубина – 2-2,5 м. Питание пруда происходит за счет талых вод, грунтовых вод и атмосферных осадков. Дно илистое, берег с западной стороны обрывистый, высотой 0,7-0,9 м, с восточной – пологий. Образован на месте оврага.
Пруд находится в окружении деревьев – сосен, берёз, тополей. Казалось бы зона вполне благоприятная, но длительное время возле пруда находилась свалка мусора, а в 50 метрах проходит автомобильная дорога. Раньше пруд использовался для отдыха – купания, рыбалки. Сейчас вода используется для орошения, в противопожарных целях (недалеко от него находится пожарная часть).
Пруд № 2 расположен в юго-западной части посёлка. Он имеет округлую форму, длина его – 40 м, ширина – 34м, глубина – 3,5-4м. Питание пруда происходит за счет атмосферных осадков, грунтовых вод, весенних талых вод. Дно илистое, берега невысокие с одиноко стоящими ивами. С 3-х сторон его окружают шоссейные дороги, с 4-й стороны к нему примыкают дома с гаражными постройками и огородами. Кроме того, недалеко проходит железная дорога. Этот пруд создан искусственно для хозяйственных нужд: орошения близлежащих земель, на случай пожара.
Методы исследования физических показателей воды
Осенью 2016 года проведен разовый отбор проб под поверхностью воды (15-30 см под поверхностью) у берега и в середине в 2-х прудах р.п. Мухтолово. Использовали посуду из прозрачного стекла с завинчивающимися пробками. Для проведения исследований были выбраны физико-химические показатели воды.
Методика исследования взята из журналов: «Биология в школе» № 5, 1996, «Химия в школе» № 3, 1997, «Унифицированные методы анализа вод»; изд. «Химия», 1973.
Запах воды определяли при 20 градусах Цельсия. Для определения запаха налили в коническую колбу со стеклянной пробкой исследуемой воды на 2/3 объема и сильно встряхнули в закрытом состоянии. Затем открыли колбу и отметили характер и интенсивность запаха в баллах, используя табл. 1.
Прозрачность воды определяли с помощью плоскодонного стеклянного цилиндра диаметром 2-2,5 см объемом 250 мл без пластмассовой подставки. Установили цилиндр на печатный текст и вливали исследуемую воду, следя за тем, чтобы можно было читать через воду напечатанный текст. Отметили, на какой высоте исчезает видимость шрифта. Измерили высоту столба воды линейкой.
Температуру воды определяли ртутным термометром с ценой деления 0,5-1 градуса. Обязательное условие – когда производится отсчет, термометр из воды не вынимают.
Цвет воды определяли в пробирке, сравнивая цвет образца с цветом того же объема чистой дистиллированной воды при дневном освещении. Единицей цветности служат градусы.
Таблица 1
|
Характеристика запаха |
Интенсивность запаха (балл) |
|
Отсутствие ощутимого запаха |
0 |
|
Очень слабый запах – не замечается потребителями, но обнаруживается специалистами |
1 |
|
Слабый запах – обнаруживается потребителями, если обратить на это внимание |
2 |
|
Запах легко обнаруживается |
3 |
|
Отчетливый запах – неприятный и может быть причиной отказа от питья |
4 |
|
Очень сильный запах – делает воду непригодной для питья |
5 |
Таблица 2
|
Цвет сбоку |
Цвет сверху |
Цветность (в градусах) |
|
Не отмечен |
Не отмечен |
0 |
|
Не отмечен |
Очень слабый желтоватый |
20 |
|
Очень слабый Бледно-желтый |
желтоватый |
40 |
|
Бледно-желтый |
Слабый желтый |
60 |
|
Бледно-желтый |
желтый |
150 |
|
Бледно-желтый |
Интенсивно желтый |
300 |
Химические методы определения главнейших примесей воды
Многие химические соединения, превышающие ПДК, могут нанести непоправимый вред, как самому водоему, так и его обитателям, поэтому мы решили качественно и, по возможности, количественно определить наличие таких соединений в наших прудах.
1. Жесткость воды зависит от содержания в ней ионов кальция и магния. Простейшую оценку жесткости воды можно провести, добавляя в пробирку с исследуемой водой мыльный раствор по каплям. В мягкой воде появление мыльной пены при взбалтывании произойдет при меньшем количестве мыльного раствора, чем в жесткой.
Жесткость воды вычисляли по формуле, используя данные химического анализа. Брали 100 мл пробы воды, добавляли по 5 мл буферного раствора, несколько кристаллов кислотного хрома и титровали Трилон Б.
Формула для вычисления жесткости:
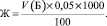
2. Определение нитратов. Нитраты встречаются почти во всех видах вод. Большое количество нитратов указывает на загрязнение в прошлом фекальными водами. При исследовании поверхностных вод по содержанию нитратов можно судить о процессе нитрификации отходов. В районах интенсивного сельского хозяйства источником нитратов могут быть нарушения при использовании минеральных удобрений.
ХОД АНАЛИЗА:
К 5 мл серной кислоты (конц.) в пробирке при постоянном помешивании прибавляют по каплям 2 мл воды. После этого вводят незначительное количество твердого бруцина (яд!) и смесь перемешивают. Появившееся желтое или коричнево-красное окрашивание указывает на присутствие нитратов. Чувствительность реакции – 1 мг/л и более.
3. Определение сульфатов. Содержание сульфатов в водоемах может быть повышенным вследствие сброса в них сточных вод с неорганическими и органическими соединениями серы.
ХОД ОПРЕДЕЛЕНИЯ:
10 мл пробы подкисляют в пробирке 0,5 мл 10 %-го раствора хлорида бария.
При содержании 5 – 10 мг/л сульфатов наблюдается слабое помутнение, при высокой концентрации – осадок сульфата бария.
4. Определение хлоридов. Многие хлорсодержащие соединения попадают в водоёмы вместе с пестицидами. Органические соединения хлора чрезвычайно опасны, так как они высокотоксичны, устойчивы в окружающей среде и живых организмах, способны к накоплению в пищевых цепях, образуют стабильные и токсичные продукты распада.
ХОД ОПРЕДЕЛЕНИЯ:
К 100 мл исследуемой воды приливаем по 1 мл хромовокислого калия и титруем нитратом серебра до появления устойчивой оранжевой окраски.
5. Определение сульфидов.
ХОД ОПРЕДЕЛЕНИЯ:
Берём 5 – 10 мл исследуемой воды и добавляем по каплям 5 % -й раствор нитрата свинца. При наличии в пробе сульфид – ионов наблюдается помутнение тёмного цвета.
6. Определение ионов железа. Железо присутствует в поверхностных и подземных водах, природная концентрация его зависит от геологического строения и гидрологических условий бассейна. Высокое содержание железа в поверхностных водах указывает на загрязнение их шахтными или промышленными сточными водами, особенно металлообрабатывающих производств, травильных цехов.
ХОД ОПРЕДЕЛЕНИЯ:
В пробирку наливаем 10 мл пробы, добавляем 1 каплю конц. азотной кислоты, несколько капель 5 %-го пероксида водорода и 0, 5 мл 20 %-го раствора роданида калия. При содержании железа около 0,1 мг/л – розовое окрашивание, при более высоком – красное.
7. Определение ионов меди. Металлы занимают особое место среди загрязнителей. Медь хоть и является микроэлементом для живых организмов, в больших дозах вызывает токсические эффекты.
ХОД ОПРЕДЕЛЕНИЯ:
Берём 10 мл исследуемой воды, добавляем несколько капель 5 % -го раствора гидроксида натрия; при наличии ионов меди менее 0,05 мг/л наблюдается образование едва заметного голубоватого помутнения, если же концентрация ионов меди больше – образуется голубой осадок гидроксида меди.
8. Определение ионов свинца. Свинец попадает в воду различными путями. В свинцовых трубах и других местах, где возможен контакт этого металла с водой и кислородом воздуха, протекают процессы окисления; в подщелоченной воде свинец может накапливаться в значительных концентрациях, так как в этом случае образуются растворимые плюмбиты. Тетраэтилсвинец – присадка к бензинам. Выхлопы автомобилей – наиболее серьёзный источник загрязнения окружающей среды свинцом.
ХОД ОПРЕДЕЛЕНИЯ:
К 10 мл исследуемой пробы добавляем несколько капель сульфида железа (II) . Наличие потемнения говорит о присутствии иона свинца в концентрации, меньшей 0, 005 мг/л; образование осадка свидетельствует о большей концентрации данного иона.
9. Определение рН воды. К изменению рН среды особенно чувствительны икра рыб и мальки. Даже обычный дождь в экологически чистой местности имеет подкисленную реакцию (рН = 5,6 – 6) за счёт того, что диоксид углерода атмосферы частично растворяется в воде с образованием гидрокарбонат – ионов.
Пагубное воздействие процессов «закисления» водоёмов на их обитателей слагается из двух факторов.
1. Прямое воздействие – когда кислоты непосредственно нарушают жизненно важные функции гидробионтов. Например, моллюски с известковыми раковинами в кислой воде лишаются своих «покровов».
2. Косвенное воздействие. «Кислая» вода взаимодействует с донными породами с высвобождением в толщу воды токсичных веществ, в частности, содержащих кадмий и ртуть. В нейтральной воде такие вещества малорастворимы и особой опасности для гидробионтов не представляют.
Принято считать, что значение рН от 5,5 до 8,5 является оптимальным для развития водных форм жизни.
Определение кислотности воды, то есть рН, определяли с помощью бумажных индикаторов. По шкале рН значение 7 является нейтральным, от 6 до 0 – кислым, а от 8 до 14 – щелочным.
Результаты исследования и их обсуждение
Запах воды вызывает летучие пахнущие вещества, попадающие в неё естественным путём. Более интенсивный запах в пруду № 2 связан скорее всего с деятельностью водных организмов, с влиянием почвы берегов и донного грунта.
Данные о прозрачности воды в водоёмах указывают, что в пруду № 2 степень насыщения воды взвешенными наносами немного больше, чем в пруду № 1, поэтому глубина проникновения в водоёмы солнечных лучей разная (в пруду № 2 глубина проникновения света меньше), и как следствие этого температура воды в пруду № 2 ниже, чем в пруду № 1.
Цвет воды определяется содержащимися в ней минеральными и органическими примесями. В пруду № 2 сверху цвет воды желтоватый. Видимо, это связано с наличием солей железа и гуминовых кислот, которые образуются при гниении растительности.
Таблица 3
|
Показатели |
1-й пруд середина |
1-й пруд берег |
2-й пруд середина |
2-й пруд берег |
Предельно допустимая концентрация |
|
Запах |
2 (слабый) |
3 (едва заметный) |
4 (болотный) |
4 (болотный) |
2 |
|
Прозрачность |
41см |
38см |
40 см |
36 см |
|
|
Температура |
16 °С |
17 °С |
14 °С |
15 °С |
|
|
Цветность |
20 очень слабый жёлт. св |
20 очень слабый жёлт. св |
40 желтоватый сверху. |
40 желтоватый сверху |
20 |
|
Жёсткость |
6,1 ммоль/л |
6,1 ммоль/л |
6,7 ммоль/л |
6,7 ммоль/л |
7 ммоль/л |
|
Наличие нитрат-ионов |
14 мг/л |
20 мг/л |
29 мг/л |
35 мг/л |
40 мг/л |
|
Наличие ионов свинца |
Отсутствуют |
Отсутствуют |
Присутствуют |
Присутстуют |
0,005 мг/л |
|
Наличие сульфат-ионов |
30 мг/л |
33 мг/л |
15 мг/л |
20 мг/л |
45 мг/л |
|
Наличие ионов железа |
Около 0,1 мг/л |
Около 0,1 мг/л |
Около 0,1 мг/л |
Около 0,1 мг/л |
0,3 мг/л |
|
Наличие хлорид-ионов |
35 мг/л |
35 мг/л |
65 мг/л |
70 мг/л |
250 мг/л |
|
Наличие сульфид-ионов |
Около 10 мг/л |
Около 10 мг/л |
Около 5 мг/л |
Около 5 мг/л |
25 мг/л |
|
Наличие ионов меди |
Менее 0,05 мг/л |
Менее 0,05 мг/л |
Чуть более 0,05 мг/л |
Чуть более 0,05 мг/л |
0,1мг/л |
|
Реакция среды, рН |
6,5 |
6 |
7 |
7 |
5,5-8,5 |
Примечание. Исследование прудов проводили по 13 – ти показателям.
Жесткость воды в обоих прудах почти достигает ПДК. Повышенное содержание ионов кальция и магния может влиять на рост и развитие рыбы. Причиной жёсткости воды является, скорее всего, связь водоёмов с водопроводной водой (рядом – неисправный водопровод).
Ни в одном из двух прудов не наблюдается превышение ПДК нитратов, но во 2-м пруду их содержание довольно высоко, что вероятно, связано с тем, что на близлежащих землях используют азотные удобрения, и с талыми водами их избыток стекает в водоём. Возможно и загрязнение фекальными водами. Отрадно, что в 1-м пруде отсутствуют ионы свинца, а вот присутствие их во 2-м водоёме, связано, по – видимому, с перемещением по шоссейным дорогам, окружающим пруд, большого количества автотранспорта. Выхлопы автомобилей содержат соединения свинца, его адсорбирует прибрежная растительность, из почвы ионы свинца перемещаются в водоём.
По содержанию сульфат – ионов на 1-м месте 1-й пруд. Видимо большое количество органических и неорганических соединений серы попало сюда с близлежащей недавно свалки. Но и здесь концентрация сульфатов не перешла уровень ПДК.
По содержанию железа воды обоих прудов примерно сходны, т.к. по близости нет залежей железосодержащих руд, нет сточных вод с большим содержанием железа, то и вода содержит небольшое его количество(не превышает ПДК = 0,3мг/л).
Большое количество хлорид – ионов (до 70 мг/л) во 2-м пруду может быть связано с использованием этого водоёма для полоскания белья, а многие СМС содержат хлорорганические соединения. Кроме того, наличие рядом гаражей, где используют различные химические вещества для обработки машин, может тоже сказаться на содержании хлора.
По содержанию ионов меди и сульфид – ионов водоёмы мало отличаются. Вода в прудах имеет нейтральное значение рН (в 1-м пруду чуть ниже).
Выводы
1. По физическим показателям вода в обоих прудах сходна, за исключением запаха (во 2-м он интенсивнее) и прозрачности (во 2-м она несколько ниже).
2. Вода в обоих прудах по качественному составу химических элементов примерно одинакова (за исключением ионов свинца во 2-м водоёме)
3. Ни одно из химических соединений не превышает ПДК.
4. Воду в прудах можно считать экологически благополучной.
5. Во 2-м пруду воду можно использовать для хозяйственных нужд и в технических целях, а в 1-м – еще и как зону отдыха.
6. Для предотвращения ухудшения экологического состояния прудов необходимо заниматься мониторингом с целью наблюдения динамических изменений по сезонам года.
Охрана прудов
Химические соединения из воды нельзя удалить механическими способами. Использование же адсорбентов и различных ионитов довольно дорого.
Многое для охраны водоёмов мы можем сделать сами, благо вода ещё пригодна для использования.
Во-первых, запретить свалки в черте посёлка (и не только у водоёмов). Они загрязняют окружающую среду, да к тому же портят эстетическое состояние населённого пункта.
Во-вторых, увеличить количество кустарниковой и древовидной растительности вокруг водоёмов. Корнями они укрепляют берег и способствуют биологической очистке воды.
В-третьих, запретить использование в качестве присадки к бензине тетраэтилсвинца, а повышать октановое число менее токсичными веществами.
В-четвёртых, проводить ежегодный мониторинг: следить за динамикой состояния воды в прудах.
И в-пятых, можно целенаправленно приобрести и разводить специальные породы рыб, способствующих биологической очистке водоёмов.
Всё зависит от нас с вами. Так как водоёмы пострадали от антропогенной нагрузки, нам и исправлять ситуацию.
Изменение качества природных вод вследствие антропогенного воздействия
Можно выделить следующие наиболее очевидные тенденции в изменении качества природных вод под влиянием хозяйственной деятельности людей:
1. Снижается рН пресных вод в результате их загрязнения серной и азотной кислотами из атмосферы, увеличивается содержание в них сульфатов и нитратов.
2. Подкисленные дождевые воды, стекая по поверхности суши и просачиваясь в нижние слои почвы, лучше растворяют карбонатные и другие породы, что вызывает увеличение содержания ионов кальция, магния, кремния в подземных и речных водах.
3. Повышается содержание в природных водах фосфатов (> 0,1 мг/л) , нитратов, нитритов и аммонийного азота.
4. Повышается содержание в природных водах ионов тяжелых металлов, прежде всего свинца, кадмия, ртути, мышьяка и цинка.
5. Повышается содержание солей в поверхностных и подземных водах в результате их поступления со сточными водами, из атмосферы за счет смыва твердых расходов. Например, солесодержание многих рек ежегодно повышается на 30-50 мг/л и более. Из 1000 т городских отходов в грунтовые воды попадает до 8 т растворимых солей.
6. Увеличивается содержание в водах органических соединений, прежде всего биологических стойких, в том числе синтетических ПАВ, гетероорганических соединений (пестицидов и продуктов их распада) и других токсичных, канцерогенных и мутагенных веществ.
7. Катастрофически снижается содержание кислорода в природных водах, прежде всего в результате повышения его расхода на окислительные процессы, связанные с эвтрофикацией водоемов, с минерализацией органических соединений, а также вследствие загрязнения поверхности водоемов гидрофобными веществами и сокращения доступа кислорода из атмосферы. В отсутствии кислорода в воде развиваются восстановительные процессы, в частности сульфаты восстанавливаются до сероводорода.
8. Существует потенциальная опасность загрязнения природных вод радиоактивными изотопами химических элементов.
Библиографическая ссылка
Яшина М.О. ОЦЕНКА СОСТОЯНИЯ ДВУХ ПРУДОВ Р.П. МУХТОЛОВА // Международный школьный научный вестник. 2017. № 1. ;URL: https://school-herald.ru/ru/article/view?id=155 (дата обращения: 18.01.2026).
