Данная статья является реферативным изложением основной работы. Полный текст научной работы, приложения, иллюстрации и иные дополнительные материалы доступны на сайте III Международного конкурса научно-исследовательских и творческих работ учащихся «Старт в науке» по ссылке: https://www.school-science.ru/0317/1/28151. Проблема кормов относится к числу важнейших проблем морской аквакультуры. При выращивании водных животных в искусственных условиях используемые корма должны полностью удовлетворять потребности организма рыб или беспозвоночных в питательных веществах (белках, жирах и углеводах), минеральных солях, микроэлементах и витаминах. На разных этапах развития гидробионтов пища должна быть соответствующего размера и формы [3].
Особенно остро в аквариумистике стоит вопрос о кормлении мальков рыб и мелких беспозвоночных животных. Например, кораллы, у которых нет симбиотических водорослей зооксантелл, должны получать корм извне, а поскольку в аквариумах обычно развивается небольшое количество фито- и зоопланктона, то в отсутствие дополнительного корма они находятся в угнетенном состоянии (рис. 1, а и б). Для поддержания нормального, здорового состояния коралла, его нужно кормить искусственно минимум раз в неделю [1, 2].
Еще одна проблема – это выращивание мальков, в частности их выкармливание. Важным этапом в жизни многих водных животных становится переход к самостоятельному питанию. Оказывается, что рыбы и ракообразные особенно требовательны к кормам именно на ранних этапах онтогенеза. Установлено, что для нормального развития и оптимального роста личинок и молоди культивируемых гидробионтов предпочтительны живые корма. В морской аквакультуре используются те кормовые организмы, которые можно выращивать в необходимом количестве в искусственных условиях [3].
В природе существует большое разнообразие зоопланктонных организмов, которые по размерам подходят в качестве корма для личинок рыб и беспозвоночных. В рыбоводстве делались попытки использовать в качестве корма зоопланктон, обитающий в естественных условиях. К недостаткам этого способа относятся неравномерность распределения зоопланктона, временные флуктуации численности, наличие форм неподходящего размера, а также нежелательных видов, которые могут оказаться хищниками или конкурировать с культивируемыми организмами. В связи с этим, если в качестве корма используется зоопланктон, его выращивают в монокультуре [7]. Многие исследователи считают, что культивирование зоопланктона как корма для морских гидробионтов необходимо проводить на одноклеточных микроводорослях (рис. 2). Одноклеточные водоросли удовлетворяют требованиям массового культивирования зоопланктонных организмов по множественным параметрам. В отличие, например, от дрожжей, они: 1) более питательны, и зоопланктон, питающийся ими, соответствует по биохимическому составу потребностям личинкам морских рыб и беспозвоночных для нормального роста и развития (табл. 1); 2) находятся в толще воды в подвижном состоянии, а не оседают на дно; 3) улучшают гидрохимический фон среды, включая в свой метаболизм отходы жизнедеятельности организмов в форме как неорганических, так и органических соединений [18].
В Севастопольском морском Аквариуме-музее, на базе которого проводились исследования, огромное количество гидробионтов, содержащихся в искусственных экосистемах. Это не только рыбы, но и многие представители беспозвоночных. В связи с потребностью обеспечения их качественным живым кормом, возникла необходимость культивирования микроводорослей. В научной литературе, посвященной данной теме, для массового культивирования микроводорослей используются люминесцентные лампы ЛД – 40 [19], в то время как на рынке появились и активно рекламируются специальные люминесцентные лампы, способствующие ускоренному росту растений – OSRAM FLUORA L 18W/77. Для подсветки океанических аквариумов часто используется специальная лампа SYLVANIA Coralstar, которую тоже решено было включить в эксперимент – дело в том, что некоторые морские организмы – в частности, актинии, кораллы и тридакны, содержат в своих тканях одноклеточные симбиотические водоросли (зооксантеллы). Эти водоросли существуют за счёт фотосинтеза и требуют хорошего освещения (в настоящее время термин «зооксантеллы» является устаревшим, в современной классификации – Symbiodinium) [6]. Виды Symbiodinium sp. обладают очень важным свойством, а именно, способностью к фотосинтезу. Для роста кораллов, несущих в своих тканях представителей Symbiodinium, требуется свет, потому что питательные вещества, полученные в результате фотосинтеза, необходимы не только для жизнедеятельности зооксантелл, но и для поддержания энергоемкого процесса кальцификации (построения скелета) самих кораллов [17]. Именно поэтому было интересно, как реагируют микроводоросли на подсветку лампой SYLVANIA Coralstar.
а б

Рис. 1. а – голодная и очень слабая тубастрея в отсаднике на откорме; б – сильная сытая тубастрея на постоянном месте в аквариуме
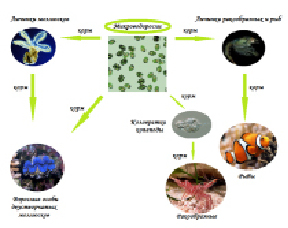
Рис. 2. Использование микроводорослей в аквакультуре
Таблица 1
Максимальное содержание (% от сухого веса) белка, углеводов, липидов в кормовых микроводорослях и их суммарная калорийность (ккал/г СВ)
|
Вид водорослей |
Белок |
Углеводы |
Липиды |
Суммарная калорийность |
|
Isochrysis galbana [18] |
49,8 |
28,4 |
25,6 |
6,24 |
|
Chlorella sp. [8] |
40 – 55 |
35,0 |
5 – 10 |
4,15 |
Таким образом, была определена цель исследования: изучить продукционные характеристики двух культур микроводорослей Isochrysis galbana, Chlorella sp. при подсветке их различными люминесцентными лампами, обычно используемыми в аквариумистике: ЛД – 40, OSRAM FLUORA L 18W/77 и SYLVANIA Coralstar. Для достижения поставленной цели следовало решить ряд задач:
1. Ознакомиться с литературой по теме исследования;
2. Изучить теоретические основы культивирования микроводорослей;
3. Подготовить посуду и необходимое оборудование;
4. Освоить микроскопию с использованием микроскопа БИОЛАМ;
5. Приготовить среду Уолна для культивирования микроводорослей;
6. Освоить методы подсчета микроводорослей;
7. Произвести посев микроводорослей в подготовленную среду;
8. Вести ежедневный подсчет количества клеток водорослей в накопительной культуре;
9. Свести все полученные данные в таблицы, произвести необходимые расчеты, построить графики;
10. Сделать выводы.
Материалы и методы
В экспериментальных исследованиях были использованы следующие микроводоросли (табл. 2) [15].
Таблица 2
Размерные характеристики и объемы клеток микроводорослей
|
Вид микроводорослей |
Длина клетки (мкм) |
Объем клетки (мкм3) |
Класс |
|
Isochrysis galbana |
3 – 5 |
39,19 |
Prymnesiophyceae |
|
Chlorella sp. |
2 – 4 |
14,14 |
Trebouxiophyceae |
Источником моновидовых накопительных культур этих микроводорослей служили линии микроводорослей, выращенные группой культивирования рыб отдела аквакультуры и морской фармакологии ИМБИ РАН, исходно полученные из музея-коллекции живых культур морских микроводорослей ИМБИ РАН (ранее ИнБЮМ).
Isochrysis galbana – золотистая микроводоросль. Клетки сферические подвижные, с двумя равными жгутиками [19].
Chlorella sp. – микроскопическая зеленая водоросль [11].
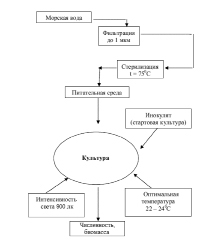
Рис. 3. Схема подготовки питательной среды и массового культивирования микроводорослей
Использованные в экспериментах микроводоросли выращивали в накопительном режиме на основе стерилизованной черноморской воды обогащенной средой Уолна [12], при температуре 23 ± 1.5°С (рис. 3). Круглосуточное освещение интенсивностью 900 lux осуществляли с помощью люминесцентных ламп: ЛД – 40, OSRAM FLUORA L 18W/77 и SYLVANIA Coralstar (рис. 4, А и Б).
A Б

Рис. 4. Подсветка опытных емкостей с культурам микроводорослей: А – лампа ЛД-40 и SYLVANIA Coralstar: Б – лампа OSRAM FLUORA L18W/77
Определение плотности (численности) клеток водорослей методом прямого подсчета в камере Горяева [13]. Содержимое колбы с водорослями перемешивали вручную, затем пипеткой отбирали суспензию водорослей (аликвоту) и наносили по одной капле на верхнюю и нижнюю части сетки счетной камеры Горяева. Затем камеру накрывали покровным стеклом, которое притирали по бокам до появления колец интерференции. Капли суспензии водорослей наносили не подряд из одной пипетки, а при двукратном взятии суспензии в пипетку из одной и той же колбы. Через 1–2 мин после оседания клеток водорослей камеру Горяева помещали под объектив бинокулярного микроскопа БИОЛАМ ЛОМО с фазовым контрастом КФ-4 и подсчитывали количество клеток водорослей во всех 25 больших квадратах сетки (рис. 5).
Плотность (численность) клеток водорослей в 1 см суспензии водорослей рассчитывали по формуле:
X=m•104,
где m – суммарное количество клеток водорослей в учтенных больших квадратах сетки; 104 – коэффициент пересчета кубических миллиметров в кубические сантиметры.
Плотность (численность) клеток водорослей подсчитывают в каждой колбе, отбирая по две аликвоты.

Рис. 5. Подсчет численности клеток микроводорослей методом прямой микроскопии с фазовым контрастом
Биомасса водорослей. Принимая удельный вес клетки пресноводных и солоноватоводных видов равным единице, биомассу водорослей вычисляли по формуле [5]:
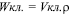 (мкг/мл),
(мкг/мл),
где Wкл. – биомасса; Vкл. – объем клетки; ρ – удельный вес.
Удельную скорость роста (μср.) за определенный промежуток времени определяли по формуле
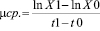 (сут-1),
(сут-1),
где X1 и X0 – биомасса организмов соответственно в начале и конце роста; t1 – t0 – время роста [4, 5].
Люминесцентные лампы, использованные в эксперименте и их характеристики
На рис. 6 представлены пики фотосинтеза и синтеза хлорофилла, которые приходятся на длины волн 445 нм и 660 нм [16].
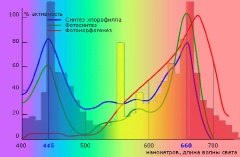
Рис. 6. Влияние длины волны на развитие растения
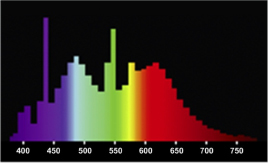
Рис. 7. График спектрального распределения светового потока люминесцентной лампы ЛД-40 («белая»)
Лампа ЛД-40 – «белая»
Лампы люминесцентные серии ЛД – лампы люминесцентные низкого давления (рис. 7). Все люминесцентные лампы отличаются повышенной световой отдачей, небольшим потреблением энергии и очень длительным сроком службы [9].
FLUORA L 18W/77 (T8) – «розовая»
Люминесцентная трубчатая лампа FLUORA L 18W/77 (T8) идеальна для подсветки растений и аквариумов [20]. Благодаря увеличенной доли красного и синего спектрального излучения лампы, позволяет обеспечить фотобиологические процессы (фотосинтез и фотоморфогенез), способствующие ускоренному росту растений (рис. 8). Использование в аквариуме данной лампы позволяет значительно ускорить рост, улучшить окраску и форму аквариумных растений.
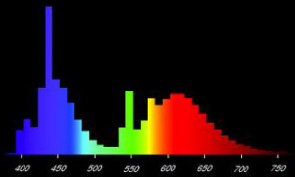
Рис. 8. График спектрального распределения светового потока люминесцентной лампы FLUORA L 18W/77 (T8) («розовая»)
SYLVANIA Coralstar – «голубая»
SYLVANIA Coralstar – люминесцентные лампы для подсветки морских аквариумов, создающие естественные условия освещения как на коралловом рифе при глубине 6 -10 м посредством актинического синего излучения (рис. 9). Способствуют росту кораллов и беспозвоночных животных. Подчеркивают естественный цвет кораллов. Лампы SYLVANIA Coralstar применяются для освещения кораллов и беспозвоночных животных в аквариумах с морской водой [10].
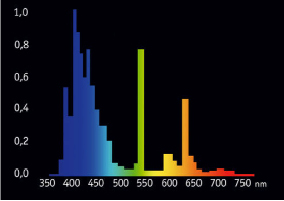
Рис. 9. График спектрального распределения светового потока люминесцентной лампы SYLVANIA Coralstar («голубая»)
Библиографическая ссылка
Кваша А.В. КУЛЬТИВИРОВАНИЕ МИКРОВОДОРОСЛЕЙ ISOCHRYSIS GALBANA И CHLORELLA SP. ПРИ ИСПОЛЬЗОВАНИИ РАЗЛИЧНЫХ ЛЮМИНЕСЦЕНТНЫХ ЛАМП: ЛД – 40, OSRAM FLUORA L 18W/77 И SYLVANIA CORALSTAR // Международный школьный научный вестник. 2017. № 3-2. ;URL: https://school-herald.ru/ru/article/view?id=266 (дата обращения: 10.03.2026).
