Данная статья является реферативным изложением основной работы. Полный текст научной работы, приложения, иллюстрации и иные дополнительные материалы доступны на сайте V Международного конкурса научно-исследовательских и творческих работ учащихся «Старт в науке» по ссылке: https://school-science.ru/5/13/34580
Подготовка к единому государственному экзамену требует от выпускников не только глубокого и полного усвоения учебного материала, но и выработки навыков практического применения имеющихся знаний.
Это подтолкнуло нас к созданию интерактивного пособия по теме: «Соединения хрома». Актуальностью работы является то, что при использовании данного пособия для подготовки к ЕГЭ, выпускник не только повторяет и закрепляет теоретические сведения по заданному разделу, но и может наблюдать химические реакции с участием соединений хрома.
В качестве объекта исследования нами были выбраны соединения хрома (III) и соединения хрома (VI).
Предмет исследования – химические реакции, лежащие в основе лабораторных способов получения, окислительно-восстановительных процессов, кислотно-основных свойств соединения хрома (III), (VI) и наиболее часто встречающиеся в заданиях ЕГЭ.
Гипотеза: если грамотно подойти к изучению соединений хрома на основе химического эксперимента, то это будет способствовать более прочному усвоению основных теоретических вопросов в изучении соединений хрома.
Цель работы: создание интерактивного пособия по теме «Соединения хрома».
Задачи:
1. Изучить литературные источники, связанные с выбранной темой.
2. Познакомиться с соединениями хрома (III) на практике, рассмотреть их способы получения и химические свойства.
3. Провести необходимые реакции с участием соединений хрома (VI).
4. Проанализировать результаты опытов и сделать выводы.
5. Разработать интерактивное пособие по теме «Соединения хрома».
6. Представить свою работу школьникам, проявляющим интерес к предмету химия и выбравшим его для итоговой аттестации.
Методы и приемы реализации поставленных целей и задач:
1. Обобщение, систематизация, анализ.
2. Практическая работа, экспериментальные исследования.
3. Наблюдение.
4. Рекламная деятельность.
Глава 1. Теоретическая часть
1.1. Общие сведения о хроме
Хром серебристо-белый тугоплавкий металл, при обычных условиях неактивен за счет плотной оксидной пленки Сr2О3, которая разрушается при нагревании; tпл 18900С; природные минералы: FeOСr2О3 – хромистый железняк, FeCrO4 – хромит; электронная формула: 1s22s2p63s2p6d54s1 – наблюдается провал одного электрона с 4s- на 3d-подуровень с образованием устойчивого наполовину заполненного 3d-подуровня; электронно-графическая формула:
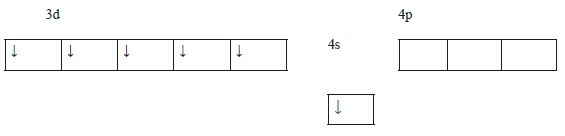
За счет шести валентных электронов и шести валентных орбиталей проявляет максимальную степень окисления +6 и валентность (VI). В соединениях обычно проявляет степени окисления +2, +3, +6, среди которых наиболее устойчивы соединения Сr3+ (см. приложение 1) [5].
С ростом степени окисления основные свойства оксидов и гидроксидов постепенно сменяются кислотными, восстановительная способность соединений убывает, а окислительная – возрастает. Так, соединения хрома (II) (CrO, Cr(OH)2) имеют основный характер и являются сильными восстановителями; высшему оксиду хрома CrO3 соответствуют хромовая H2CrO4 и двухромовая кислоты H2Cr2O7, для них характерны окислительные свойства. Соединения хрома в промежуточной степени окисления, главным образом +3 (Сr2О3, Cr(OH)3), амфотерны (см. приложение 2,3). Они наиболее устойчивы в водных растворах по отношению как к окислению, так и к восстановлению [7].
1.2. Соединения хрома (II)
Оксид хрома (II) CrO – пирофорный порошок черного цвета (см. приложение 2).
Получение
Образуется при окислении амальгамы хрома кислородом воздуха:
2Cr/Hg + O2 = 2CrO + 2Hg, а также при термическом разложении карбонила: Cr(CO)6 = CrO + 5CO + C
Химические свойства
Основные свойства проявляются в его взаимодействии с разбавленной соляной кислотой: CrO + 2HCl = CrO + H2O
CrO + разбавленные серная и азотная кислоты и щелочи ≠ нет реакции
CrO + H2O ≠ нет реакции, не растворяется
При растирании на воздухе или нагревании оксид хрома (II) воспламеняется, сгорая до оксида хрома (III), а при температуре белого каления даже способен отнимать кислород у углекислого газа:
4СrO(т) + О2(г) = 2Сr2О3(т) зеленый, 2СrO + СО2 = Сr2О3 + СО.
Нагревание в инертной атмосфере или вакууме приводит к диспропорционированию: 3СrO = Сr2О3 + Сr (7000С; вакуум).
При температуре 10000С водород восстанавливает СrO до металла:
СrO (т) + H2 = Сr + H2O [5;7].
Гидроксид хрома (II) Cr(ОН)2 – вещество коричневого или желтого цвета, плохо растворимый в воде, проявляет основные свойства, медленно реагирует только с концентрированными кислотами, образуя соли хрома (II) синего или голубого цвета, хороший восстановитель (см. приложение 2).
Получение
В виде желтого осадка Cr(OH)2 получают при действии раствора щелочи на хлорид хрома (II): CrCl2(т) + 2NaОН(р) = Cr(OH)2vжелтый + 2NaCl [5].
Химические свойства
Кислотно-основные свойства. Cr(ОН)2 проявляет основные свойства; взаимодействует только с кислотами: Cr(ОН)2 + 2ОН3++ 2Н2О → [Cr(ОН2)6 ]2+. Образующиеся при этом аквакомплексы [Cr(ОН2)6]2+ синего цвета. Такую же окраску имеют кристаллогидраты, например: Сr(ClO4)26H2O [1].
Сr(ОН)2(т) + разбавленные кислоты и щелочи ≠ нет реакции
Сr(ОН)2(т) + 2HCl(к) = CrCl2(р) голубой + 2H2O
Сr(ОН)2(т) = CrO(т) + H2O (t, в отсутствии кислорода)
Восстановительные свойства (легко окисляется кислородом воздуха)
4Сr(ОН)2(т) желтый + О2(г) + 2Н2О = 4Сr(ОН)3vсеро-зеленый
4Сr(ОН)2vжелтый + О2(г) = 4СrО(ОН)vзеленый + 2Н2О
СrО(ОН) + 3NaОН(расплав) + Н2О = Na3[Cr(OH)6]зеленый
4Сr(ОН)2(т) желтый + О2(г) = 2Сr2О3v+ 4Н2О (t) [5].
Соли хрома (II). Известны галогениды хрома (II), сульфаты и перхлораты; водные растворы соединений хрома (II) небесно-голубого цвета, тогда как безводные соли бесцветны. Все соли хрома (II) – сильные восстановители (см. приложение 3), в растворах окисляются кислородом воздуха:
4CrCl2 + O2 + 4HCl = 4CrCl3 + 2H2O.
При отсутствии окислителя восстанавливают даже воду, разлагая ее с выделением водорода: 2CrCl2(т) + 2H2O = 2CrOHCl2 + H2↑(t)
2CrCl2(т) + 4H2SO4(к) = Cr2(SO4)3 + SO2↑ + 4HCl + 2H2O (кипение)
CrCl2(т) + 2NaОН(р) = Cr(OH)2v + 2NaCl
4CrCl2(т) + О2 + 2H2O = 4CrOHCl2
CrCl2(р) + (NH4)2S(т) = CrSv + 2NH4Cl
Хлорид хрома (II) CrCl2. В безводном состоянии представляет собой белые кристаллы с шелковистым блеском. Получаются при восстановлении солей хрома (III) водородом в момент выделения:
2CrCl3 + 3Zn + 4HCl = 2CrCl2 + 3ZnCl2 + 2H2 [5].
Комплексные соединения хрома (II). Хром (II) из-за относительно малого заряда и большого размера иона Сг2+ является относительно слабым комплексообразователем. Однако он образует как катионные, так и анионные комплексные соединения. С аммиаком хлорид хрома (II) образует соединения: [Cr(NH3)6]Cl2 (темно-голубой), [Cr(NH3)5]Cl2 (фиолетовый), [Cr(NH3)3]Cl2 (светло-голубой), [Cr(NH3)2]Cl2 (светло-зеленый), [Cr(NH3)]Cl2 > CrCl2 + NH3 (4000C) [5, 8]
1.3. Соединения хрома (III)
Оксид хрома (III) Сr2О3 (хромовая охра) — темно-зеленое тугоплавкое вещество (по твердости сравнимо с корундом). Химическая активность Сr2О3 зависит от способа его получения. Благодаря высокой энергии кристаллической решетки не реагирует с водой, с растворами кислот и щелочей; перевести его в растворимое состояние можно только в очень жестких условиях, сплавляя со щелочами, карбонатами, сильными окислителями (см. приложение 2) [1].
Получение
(NH4)2Cr2O7 = N2↑ + Cr2O3 + 4H2O (t)
4Cr + 3O2 = 2Cr2O3 (500-7000C), 2Cr(OH)3 = Cr2O3 + 3H2O (t)
Cr(OH)3 = CrO(OH) + H2O (t), 2CrO(OH) = Cr2O3 + H2O (150°C)
4K2Cr2O7 = 4K2CrO4+ 2Cr2O3(т) + 3O2 (t>4500C)
2K2Cr2O7(т) + 3C(т) = 2Cr2O3(т) +2K2CO3 + CO2 (t, прокаливание)
Химические свойства
Кислотно-основные свойства (см. приложение 2). Оксид хрома (III)
химически активен, проявляет отчетливо выраженные амфотерные
свойства: Cr2O3 + H2O ≠ нет реакции
Cr2O3 + 2MeOH(плав) = 2MeCrO2 + H2O (400-500 0C, Me = Li, Na, K)
Сr2О3 + Na2CO3(т) = 2NaCrO2 + СО2↑ (сплавление)
Сr2О3 + 6KHSO4(т) = 3K2SO4 + Cr2(SO4)3 +3H2O (сплавление)
Сr2О3+ 3H2SO4(р) = Cr2(SO4)3 + 3H2O (t)
Сr2О3 + 6NaOH + 3Н2О →2Na3[Cr(OH)6]
Окислительно-восстановительные свойства (см. приложение 3):
2Сr2О3 + O2 = 4CrO2(черный) (400 °C, Р)
При высокой температуре оксид хрома (III) восстанавливается алюминием, кальцием, водородом, углеродом:
Сr2О3+ 2Al > 2Сr + Al2O3 (8000C); Сr2О3+ 3Са → 2Сr + 3СаО
Сr2О3+ 3H2 > 2Сr + 3Н2О; 2Сr2О3+ 3С> 4Сr + 3СО2 ↑(800°C)
Сr2О3 + 2K2CO3(т) + KClO3(т) = 2K2CrO4 + KCl + 2CO2↑ (500-700°C)
Сr2О3(т) + 2KMnO4(т) = K2CrO7 + 2MnO2 (сплавление) [1,5,7].
Гидроксид хрома (III) Сr(ОН)3, а точнее гидрат оксида Cr2O3·3H2O - твердое вещество зеленого цвета, в виде студнеобразного осадка, типичный амфотерный гидроксид (см. приложение 2), плохо растворим в воде, легко взаимодействует с кислотами и щелочами.
Получение
Cr2(SO4)3(р) + 6NaOH(р)(по каплям) = 2Сr(ОН)3v + 3Na2SO4
Cr2(SO4)3(р) + 6NH3+H2O = 2Сr(ОН)3v+ 3(NH4)2SO4
Na3[Cr(OH)6](р) + 3CO2 = 2Сr(ОН)3v+ 3NaHCO3
Химические свойства
Сr(OH)2- + OH - [Cr(OH)3 - H3CrO3] → H2O + HCrO2 - H+ + CrO2-
по типу основания ←[диссоциация]→ по типу кислоты
2Сr(ОН)3= Сr2O3 + 3H2O (t)
Кислотные свойства: Сr(ОН)3(т) + 3КОН(к) = К3[Сr(ОН)6](р) зеленый
Сr(ОН)3(т) + 3КОН(р) + 2H2O = K[Cr(OH)4(H2O)4] (р) зеленый
Сr(ОН)3(т) + 3КОН(т) = KCrO2+2H2O (400-5000C, сплавление)
Основные свойства: 2Сr(ОН)3(т) + 3H2SO4(р) = Cr2(SO4)3 + 6H2O
Сr(ОН)3(т) + 3HCl(р) = CrCl3 + 3H2O
Сr(ОН)3(т) + 6KSCN(р) = K3[Cr(SCN)6] темно-красный + 3KOH
Восстановительные свойства (см. приложение 3):
2Сr(ОН)3(т) + 3H2O2 + 4NaOH(к) = 2Na2CrO4 + 8H2O
2Сr(ОН)3(т) + 3Br2(р) +10NaOH(к) = 2Na2CrO4 + 6NaBr + 8H2O
Na3[Cr(OH)6] (р)+ 3Br2(р) + 4NaOH(к) = 2Na2CrO4 + NaBr + 8H2O [5, 6, 8]
Получение гидроксида хрома (III) и его переход в катионные [Cr(OH2)6]3+ и анионные [Cr(OH)6]3- комплексы можно выразить следующим суммарным уравнением:
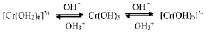
Аквакомплекс [Cr(OH)6]3+ сине-фиолетового цвета входит в состав ряда кристаллогидратов Сr(III), например в фиолетовые CrCl3 6H2О, CrBr3 6Н2О, KСr(SО4)2 12Н2О (хромокалиевые квасцы). Результаты рентгеноструктурного анализа и окраска хромовых квасцов говорят в пользу структуры [Ме(ОН2)6] [Сr(ОН2)6](SО4)2. Таким образом, квасцы представляют собой двойные соли. Они образуются при взаимодействии растворов Ме2SO4 и Cr2(SO4)3. Квасцы, как и некоторые другие производные Сr(III), используются в качестве протравы в красильном деле и при дублении кожи.
В зависимости от условий состав катионных аквакомплексов изменяется, что сопровождается изменением их окраски от фиолетовой до зеленой (см. приложение 4). Так, СrСl3 6H2O в зависимости от ориентации молекул воды и хлорид-ионов имеет следующие изомерные формы:
|
[Сr(ОН2)6]Сl3 |
[Cr(ОН2)5]С1·Н2О |
[Сr(ОН2)4Сl2]Сl ·2Н2О |
|
сине-фиолетовый |
светло-зеленый |
темно-зеленый |
Кроме аквакомплексов для Cr(III) известны катионные амминокомплексы [Cr(NH3)6]3+ (фиолетового цвета). Аммиакаты в твердом состоянии устойчивы. В водных же растворах они постепенно разрушаются:
[Cr(NН3)6]С13 + 3Н2О - Сr(ОН)3 + 3NH4C1+ 3Н3N
Поэтому получение аммиакатов всего легче осуществляется в неводных растворах или в жидком аммиаке.
Производные анионных комплексов хрома (III) - весьма разнообразны. Ниже приведены уравнения реакций их получения:
3КОН + Сr(ОН)3 > К3[Cr(ОН)6] гексагидроксохромат (III) зеленый
3КС1 + CrCl3 > К3[CrCl6] гексахлорохромат (III) розово-красный
Гексагидроксохромат (III)-ионы [Сr(ОН)6]3- окрашены в изумрудно-зеленый цвет. Гексахлорохромат(III)-ионы [CrCl6]3- окрашены в зеленый цвет. Известны комплексные хлориды состава 3КС1 CrCl3, которые являются производными двухядерных комплексов [Сr2Cl9]3- [1].
Соли хрома (III). Соли хрома (+3) имеют разную окраску: от красно-фиолетовой (или розовой) – для безводных солей, через зеленую к сине-фиолетовой для кристаллогидратов. Окраска соли зависит от гидратности и строения гидратов (см. приложение 4) [5].
Получение
Сr2О3 + 3С + 3С12 = 2СrС13 + 3CO
Cr(OH)3 + 3HC1 = СrС13 + 3Н2О, Сr2О3 + 6HNO3 = 2Cr(NO3)3 + 3Н2О,
Сr2О3 + 2КОН = 2КСrO2 + Н2О (t), Сr(ОН)3 + 3КОН = К3[Сr(ОН)6]
Химические свойства
Гидролиз, щелочной гидролиз
Соли Сr (III) в водных растворах подвергаются гидролизу; растворы солей сильных кислот имеют кислую реакцию: СrС13 + Н2О - CrOHCl2 + HC1
Некоторые соли Сr (III) гидролизуются полностью (Cr2S3, Сr2(СО3)3), поэтому их нельзя получить по обменным реакциям в растворах:
Cr2S3 + 6Н2O = 2Сr(ОН)3v + 3H2S↑
Соли хрома (III) катионного типа реагируют со щелочами
2CrCl3 +3NH3·H2O(р) = Сr(ОН)3v + NH4Cl
CrCl3 + 3NaOH = Сr(ОН)3v + 3NaCl (при медленном добавлении)
Соли хрома (III) анионного типа разлагаются кислотами:
Na3[Cr(OH)6] + 6НС1 = 3NaCl + CrCl3 + 6Н2О,
K3[Cr(OH)6] + 3НС1 = 3КС1 + Сr(ОН)3v + 3Н2О
Окислительно-восстановительные свойства
Все соединения трехвалентного хрома сравнительно легко окисляются в соли хромовой или двухромовой кислоты (см. приложение 3). Окисление может быть осуществлено действием различных окислителей:
2CrCl3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 8H2O + 6NaCl
Сr2(SO4)3(р) + K2SO4(к) + 12H2O = 2KCr(SO4)·12H2O темно-фиолетовые хромокалиевые квасцы
Сr2(SO4)3(р) + 3Br2(р) + 16NaOH(р) = 2Na2CrO4 + 6NaBr + 3Na2SO4 + 8 H2O
Сr2(SO4)3(р) + Zn = 2CrSO4 + ZnSO4
Cr2S3(т) + 12NaOH(к) = 2Na3[Cr(OH)6] + 3Na2S
Cr2S3(т) + 6H2SO4(к) = Cr2(SO4)3 + 3Sv + 3SO2↑ + 6H2O [1, 5, 7].
1.4. Соединения хрома (VI)
Оксид хрома (VI) СrО3 – вещество темно-красного цвета; кислотный оксид; сильный окислитель, хорошо растворим в воде, ядовит (см. приложение 2,3) [5].
Получение
Темно-красные кристаллы хромового ангидрида образуются при действии концентрированной серной кислоты на насыщенный раствор дихромата калия или натрия: 2H2SO4 + К2Сr2О7 → 2СrO3v + 2KHSO4 + H2О [7].
Химические свойства
Кислотно-основные свойства. СrO3 имеет кислотный характер: легко растворяется в воде, образуя хромовые кислоты. С избытком воды образует хромовую кислоту Н2СrO4: СrO3(т)+ Н2О = Н2CrO4. При большей концентрации СrO3 образуется дихромовая кислота H2Cr2O7: 2СrO3(т) + Н2О = Н2Сr2O7, которая при разбавлении переходит в хромовую кислоту: Н2Сr2O7 + Н2О = 2Н2СrO4. Хромовые кислоты существуют только в водном растворе. Однако их соли весьма устойчивы [8].
Оксид хрома (VI) реагирует со щелочами и основными оксидами, образуя хроматы: CrO3(т) + K2O(т) = K2CrO4 (t), СrО3(т) + 2NaOH(р) = Na2CrO4(р)+ H2O
2СrО3(т) + 2NH3•H2O(р) = (NH4)2Сr2O7 + H2O
СrО3(т) + 2NH3•H2O(к) = (NH4)2СrO4 + H2O
Окислительно-восстановительные свойства (см. приложение 3). CrO3 – сильный окислитель:
3СrO3(т) = СrO2 + Сr2О3 + 2О2↑(370°С); 4СrO3 = 2Сr2О3 + 3О2↑
СrO3(т) + 3Н2 = Сr + 3Н2О; 2СrO3(т) + 3Н2 = Сr2О3 + 3Н2О
4СrO3 + 3С = 3СO2↑ + 2Сr2О3(t); 2СrO3 + 3СО = 3СO2↑ + Сr2О3(t)
4СrO3 + 3S = 3SO2↑ + 2Сr2О3(t); 10СrO3(т) + 6P = 3P2О5 + 5Н2О(t)
2СrO3(т) + 2NH3(г) = Cr2O3 + N2↑ + 3Н2О; 2СrO3(т) + 3H2S(р) = Cr(OH)3 + 3S
14СrO3(т) + 12KI = CrI3 + 3I2↑ + 6K2Сr2O7 (t, Н2О)
4СrO3 + С2Н5ОН = 2Сr2О3 + 2СО2↑ + 3Н2О
4СrO3(т) + С2Н5ОН + 6H2SO4(р) = 2Cr2(SO4)3 + 2СО2↑ + 9H2O
Реакция обнаружения спирта в выдыхаемом воздухе (при pH < 7):
4СrO3(т) красный + 3С2Н5ОН = 2Сr2О3 зеленый + 3CH3COOH + 3Н2О [5, 7]
Хромовые кислоты и их соли. Водный раствор хромового ангидрида представляет собой смесь хромовой и дихромовой кислот, которые находятся в равновесии друг с другом. Хотя ни одна кислота не выделена в свободном виде, их соли хорошо изучены. Соли хромовой кислоты называются хроматами, дихромовой – дихроматами (бихроматами).
Ионы CrO42- и Сr2О72- превращаются друг в друга при изменении концентрации водородных ионов по уравнениям:
2СrО42- + 2Н+ ↔ Сr2О72- + Н2О и Сr2О72- + 2OH- ↔ 2СrО42- + H2O
Отсюда видно, что если подкислить раствор, то равновесие будет смещаться в сторону образования дихромат-ионов Сr2О7 2- , и наоборот, если добавить щелочи, то равновесие будет смещаться в сторону образования хромат-ионов СrО42- (см. приложение 5). О взаимных превращениях этих солей легко судить по изменению окраски: хроматы имеют желтый цвет, а дихроматы – оранжевый: 2CrO4 2- (желтый) + H+ - Сr2О7 2- (оранжевый) + OH-
2К2CrO4 (р) желтый + H2SO4 - К2Сr2О7 (р) оранжевый + K2SO4 + Н2О;
2К2CrO4 (р) желтый + 2H2SO4 - К2Сr2О7 (р) оранжевый + 2KHSO4 + Н2О;
K2Cr2O7(р) оранжевый + 2КОН - 2К2СrO4 (р) желтый + H2О.
Соли щелочных металлов и аммония хромовых кислот хорошо растворимы в воде. Соли других металлов растворяются трудно. Дихроматы Na2Сr2О7 • 2Н2О и К2Сr2О7 называются хромпиками. Они как окислители применяются в лабораторной практике и химической технологии, в кожевенной, лакокрасочной, спичечной и текстильной промышленности. Хромовая смесь – так называется 3%-ный раствор дихромата калия в концентрированной серной кислоте – применяется в химических лабораториях для мытья стеклянной посуды [5, 8].
Получение
Хроматы образуются при спекании хромита с поташом на воздухе:
4(Cr2Fe II)O4 + 8K2CO3 + 7O2 = 2K2СrO4 + 2Fe2O3 + 8CO2
Дихроматы можно получить подкислением растворов хроматов:
2К2СrO4 + 2H2SO4 = K2Cr2O7 + 2KHSO4 + Н2О [6].
Химические свойства
Окислительные свойства. В кислой среде хроматы, где они присутствуют в виде дихромат-ионов, могут быть восстановлены до солей хрома (III):
K2Cr2O7 + 3SO2 + H2SO4 = K2SO4 + Cr2(SO4)3 + H2O
K2Cr2O7 +3H2S + 4H2SO4 = K2SO4 + Cr2(SO4)3 + 3Sv + 7H2O
K2Cr2O7 + 6FeSO4 + 7H2SO4 = K2SO4 + Cr2(SO4)3 + 3Fe2(SO4)3 + 7H2O
К2Сr2О7 + 6KI + 7Н2SO4 = Сr2(SO4)3 + 3I2 + 4K2SO4 + 7Н2О
К2Сr2О7 + 14HBr = 2KBr + 2СrВr3 + 3Br2 + 7Н2О
В нейтральной и слабощелочной средах хромат-ионы восстанавливаются до гидроксида хрома (III):
2K2CrO4 (к) +3(NH4)2S + 8H2O = 2Cr(OH)3v + 3Sv + 4KOH + 6NH3•H2O
2K2CrO4 (к) +3H2S + 2H2O = 2Cr(OH)3v + 3Sv + 4KOH
В сильно-щелочной – до гидроксохроматов (III) [Cr(OH)6] 3- :
2K2CrO4 (к) + 3(NH4)2S + 2KOH + 2H2O = 2K3[Cr(OH)6] + 3Sv + 6NH3
K2CrO4 (к) + Al + 4KOH + 4H2O = K3[Cr(OH)6] + K3[Al(OH)6]
В щелочной среде окислительная способность хроматов значительно ниже, поэтому для их перевода в соединения хрома (III) требуются более сильные восстановители – гидразин, борогидриды, гипосульфиты и гипофосфиты.
Обменные реакции
K2CrO4 (р) + BaCl2 (р) = ВаСrO4v желтый + 2KCl
K2CrO4 (р) + H2O + BaCl2 = ВаСrO4v желтый + 2KCl + H2CrO4
K2CrO4 (р) + 2AgNO3 (р) = Ag2СrO4v кирпично-красный + 2KNO3
Водные растворы хроматов и дихроматов токсичны [5, 6, 7, 8].
2. Экспериментальная часть
Соединения хрома (III)
Получение оксида хрома (III)
В фарфоровую чашку насыпаем небольшое количество кристаллического дихромата аммония. Формируем его в виде горки, капаем 2 капли спирта и спичкой поджигаем вершину.
Вывод. В результате бурного разложения бихромата образуются оксид хрома(III), азот и вода: (NH4)2Cr2O7 - t°С> Cr2O3 + N2↑+ 4H2O
Свойства оксида хрома (III)
В пять чистых пробирок помещаем по одному микрошпателю полученного оксида хрома (III), затем указанные в таблице объемы (порции) других веществ:
|
Пробирка № 1 |
Пробирка № 2 |
Пробирка № 3 |
Пробирка № 4 |
Пробирка № 5 |
|
|
Вещества |
2 мл Н2О (дист.) |
2 мл Н2SO4 (разб. р-р) |
2 мл KOH (разб. р-р) |
1 микрошпатель KOH (тв.) |
1 микрошпатель Na2CO3 (тв.) |
Подогреваем содержимое пробирок №№1-3, не доводя до кипения. Смеси в пробирках №№ 4 и 5 сплавляем на спиртовке. Охлаждаем продукт сплавления и растворяем его в воде.
Вывод. Оксида хрома (III) – амфотерный оксид – при комнатной температуре в воде не растворяется, инертен к действию растворов кислот и щелочей. При нагревании растворяется в растворе кислоты:
Сr2О3 + 3H2SO4(р) > Cr2(SO4)3 + 3H2O.
При сплавлении Cr2O3 с твердыми щелочами и содой получаются соединения Cr+3 – хромиты:
Cr2O3 + 2KOH > 2KCrO2 + H2O, Cr2O3 + K2CO3 > 2KCrO2 + CO2^.
Получение гидроксида хрома (III)
К 5-6 каплям раствора соли Cr3+ приливают 5-6 капель раствора аммиака. Испытывают полученный осадок на растворимость в избытке конц. NH4OH с последующим нагреванием.
Вывод. Гидроксид хрома (III) можно получить при действии на соль хрома (III) раствора аммиака: CrCl3 + 3(NH3·H2O) > Cr(OH)3v + 3NH4Cl
Кислотно-основные свойства гидроксида хрома (III)
В две чистые пробирки наливаем по 1-2 мл раствора хлорида хрома CrCl3 и приливаем понемногу раствор щелочи до образования осадка гидроксида хрома Cr(OH)3. В одну из пробирок приливаем избыток едкого кали, в другую – раствор соляной кислоты до растворения осадка.
Вывод. Гидроксида хрома (III) проявляет амфотерные свойства, реагирует с кислотами и щелочами:
Cr(OH)3v + 3HCl > CrCl3 + 3H2O, Cr(OH)3v + 3KOH > K3[Cr(OH)6].
Восстановительные свойства гидроксида хрома (III)
В чистую пробирку наливаем 1-2 мл раствора хлорида хрома (III) и приливаем понемногу раствор едкого кали до образования осадка гидроксида хрома Cr(OH)3, затем добавляем несколько капель 3%-ного раствора пероксида водорода и нагреваем пробирку.
Вывод. Гидроксид хрома (III) обладает восстановительными свойства, так как в ходе реакции наблюдается переход зеленой окраски раствора в желтую, что указывает на образование в растворе хромат-ионов CrO42?:
2Cr(OH)3v + 3H2O2 + 4KOH > 2K2CrO4 + 8H2O.
Гидролиз хромитов
Наливаем в пробирку 1-2 мл раствора хлорида хрома (III) и приливаем к нему избыток раствора щелочи до растворения выпавшего осадка (зеленого цвета) и образования раствора, имеющего ярко-зеленую окраску. Нагреем содержимое пробирки (раствор хромита) до кипения.
Вывод. В отличие от алюминатов и цинкатов хромиты необратимо разлагаются при кипячении вследствие почти полного гидролиза:
KCrO2 + 2H2O = Cr(OH)3v + KOH.
Окисление солей хрома (III) в щелочной среде
Наливаем в пробирку 1-2 мл раствора хлорида хрома (III) и приливаем к нему избыток раствора щелочи до растворения выпавшего осадка. К полученному раствору хромита добавляем 3-5 капель 3%-ного раствора перекиси водорода и слегка нагреваем пробирку.
Вывод. Соли хрома (III) при взаимодействии с пероксидом водорода в щелочной среде проявляют восстановительные свойства:
2KCrO2 + 3H2O2 + 2KOH > 2K2CrO4 + 4H2O.
Соединения хрома (VI)
Смещение равновесия между хроматами и дихроматами
В чистую пробирку наливаем 1-2 мл раствора хромата калия. Приливаем по каплям раствор серной кислоты до перехода желтого цвета раствора в красно-желтый (оранжевый) цвет вследствие образования дихромата калия. Затем приливаем по каплям раствор едкого кали до перехода красно-желтого цвета раствора в желтый вследствие образования хромата калия.
Вывод. В зависимости от среды возможен переход хроматов в бихроматы и обратно: 2K2CrO4 (желтый р-р) + H2SO4 > K2Cr2O7 (оранжевый р-р) + K2SO4 + H2O,
K2Cr2O7 (оранжевый р-р) + 2KOH > 2K2CrO4 (желтый р-р) + H2O.
Окислительные свойства дихроматов
В 3 пробирки наливаем по 1-2 мл раствора K2Cr2O7 и такой же объем 2н H2SO4. В 1-ю пробирку приливаем немного раствора иодида калия, во 2-ю добавляем один микрошпатель сульфита натрия и пробирку слегка подогреваем, в 3-ю вносим один микрошпатель сульфата железа (II) или раствор свежеприготовленной соли железа (II). Встряхиваем пробирки.
Вывод. Являясь окислителем, ион Cr2O72- восстанавливается до иона Cr3+:
K2Cr2O7 + 6KI + 7H2SO4 > Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
K2Cr2O7 + 3Na2SO3 + 4H2SO4 > Cr2(SO4)3 + K2SO4 + 3Na2SO4 + 4H2O
K2Cr2O7 + 6FeSO4 + 7H2SO4 > Cr2(SO4)3 + K2SO4 + 3Fe2(SO4)3 + 7H2O
Реакция с нитратом серебра
Наливаем в одну пробирку раствор хромата калия (желтый цвет), в другую – раствор дихромата калия (оранжевый) и добавляем по 2-3 капли раствора нитрата серебра.
Вывод. Обе реакции сопровождаются образованием красно-бурого осадка, что указывает на присутствие в растворе ионов CrO42- и Cr2O72-:
K2CrO4 + 2AgNO3 > Ag2CrO4v + 2KNO3,
K2Cr2O7 + 2AgNO3 > Ag2Cr2O7v + 2KNO3.
Реакция с хлоридом бария
В одной пробирке смешиваем 1-2 мл раствора хромата калия (желтый цвет) и хлорид бария, в другой – дихромат калия (оранжевый) и хлорид бария.
Вывод. Образование желтого осадка BaCrO4 указывает на присутствие в растворе ионов CrO42-: K2CrO4 + BaCl2 > BaCrO4v + 2KCl;
K2Cr2O7 + 2BaCl2 + H2O > 2BaCrO4v + 2KCl + 2HCl
Получение пероксида хрома
В пробирку наливаем 2 мл 3%-ного раствора перекиси водорода и 3 мл разбавленной серной кислоты. Смесь перемешиваем и добавляем к ней 0,5 мл бутилового (амилового) спирта и несколько капель раствора дихромата калия. Осторожно взбалтываем содержимое пробирки.
Вывод. При взаимодействии соли хрома с пероксидом водорода в кислой среде образуется неустойчивый пероксид хрома CrO5:
К2Сr2О7 + 4Н2O2 + H2SО4 = 2CrO5 + К2SО4 + 5H2О.
Выводы
В ходе проведенной исследовательской работы:
– изучен и обобщен материал по соединениям хрома:
1. С увеличением степени окисления металла основные свойства оксидов и гидроксидов ослабевают, а кислотные усиливаются.
2. Окислительные свойства последовательно усиливаются с изменением степени окисления в ряду: Сr+2 > Сr+3 > Сr+6.
3. Соединения хрома весьма разнообразны по окраске.
4. Все хромовые кислоты и их соли, а также оксид хрома (VI) ядовиты;
– проведены необходимые реакции с участием соединений хрома (III) и соединений хрома (VI) на практике, проанализированы результаты опытов и сделаны выводы;
– разработано и апробировано на уроках химии и элективных занятиях интерактивное пособие «Соединения хрома» (см. приложение 6).
Материал, представленный в работе, может быть использован как на уроках химии, так и во внеурочной деятельности по предмету.
Интерактивное пособие «Соединения хрома» помогает выпускникам средней школы и учащимся овладеть более прочными знаниями по предмету. Принцип, положенный в основу данного пособия, может быть использован при создании подобных приложений по другим учебным дисциплинам.
Многогранность исследуемой темы открывает возможность для дальнейшей работы, направленной на решение проблем, требующих от выпускников не только глубокого усвоения учебного материала, но и выработки навыков практического применения имеющихся знаний.
Библиографическая ссылка
Талышева А.А., Деева М.И. ИССЛЕДОВАНИЕ СОЕДИНЕНИЙ ХРОМА // Международный школьный научный вестник. 2018. № 5-4. ;URL: https://school-herald.ru/ru/article/view?id=727 (дата обращения: 10.03.2026).
