В результате жизнедеятельности организмов, а также в процессе сгорания органических веществ выделяется оксид углерода (IV) – углекислый газ CO2. По своей химической природе он является кислотным оксидом [1], соответствующим слабой угольной кислоте H2CO3. В водных растворах это соединение не устойчиво, распадается с образованием СО2 и Н2О [1, 176]. Угольная кислота способна образовывать два вида солей – карбонаты (с кислотным остатком CO32-) и гидрокарбонаты (кислотный остаток HCO3-). Большинство гидрокарбонатов хорошо растворимо в воде, из карбонатов растворимы соединения щелочных металлов и соли аммония.
Раствор углекислого газа в воде – бесцветная прозрачная жидкость. В природе карбонаты встречаются, как правило, в виде белых минералов – магнезита (MgCO3), кальцита (CaCO3), доломита (CaCO3·MgCO3) и т.п. [2]. Из окрашенных природных соединений можно выделить коричневый или зеленовато-серый сидерит FeCO3 [3], зеленый малахит CuCO3·Cu(OH)2 [4]. Интересной экспериментальной задачей является установление зависимости окраски карбонатов от химического состава. В этой связи целью работы являлось получение ряда карбонатов металлов s- и d-элементов, изучение их свойств: от чего зависит цвет карбоната, как они взаимодействуют с кислотами.
Материалы и методы исследования
Для проведения исследования были использованы растворы солей с концентрацией 0.5 моль/л: нитрат никеля (II) Ni(NO3)2; сульфат кобальта (II) CoSO4; сульфат меди (II) CuSO4; сульфат магния MgSO4, нитрат кальция Ca(NO3)2; нитрат стронция Sr(NO3)2; нитрат бария Ba(NO3)2; карбонат калия K2CO3. Все растворы были приготовлены из реактивов марки «ч». Для растворения полученных осадков использовали раствор соляной кислоты HCl с концентрацией 1 моль/л. Для изучения характера воздействия кислоты на карбонат природного происхождения использовали мел.
Для получения карбонатов в пробирки помещали по 3 мл раствора соли соответствующего s- или d-элемента, затем приливали раствор карбоната калия до образования осадка. Цвет осадка фиксировали визуально.
Для изучения влияния раствора кислоты на полученные осадки в реакционную систему добавляли при перемешивании HCl до растворения осадка.
Для изучения воздействия кислоты на карбонат природного происхождения мел растирали в порошок, помещали на горизонтальную поверхность и капали раствором кислоты.
Результаты и обсуждение
Получение карбонатов:
Получение карбоната никеля (II) можно описать с помощью реакций:
Ni(NO3)2 + K2CO3 = NiCO3v + 2KNO3
Ni2+ + CO32- = NiCO3v
При взаимодействии светло-зеленого раствора нитрата никеля (II) и бесцветного раствора карбоната калия образуется карбонат никеля (II) – аморфный осадок салатового цвета (рис. 1, а).


а) б)

в)
Рис. 1. Образование осадков карбонатов переходных металлов: а – NiCO3 ,
б – CoCO3 , в – CuCO3
Получение карбоната кобальта (II) можно описать с помощью реакций:
CoSO4 + K2CO3 = CoCO3v + K2SO4
Co2+ + CO32- = CoCO3v
При взаимодействии раствора сульфата кобальта (II) малинового цвета и бесцветного раствора карбоната калия образуется карбонат кобальта (II) – малиновый аморфный осадок (рис. 1, б).
Получение карбоната меди (II) можно описать с помощью реакций:
CuSO4 + K2CO3 = CuCO3v + K2SO4
Cu2+ + CO32- = CuCO3v
При взаимодействии раствора сульфата меди (II) голубого цвета и бесцветного раствора карбоната калия образуется карбонат меди (II) – аморфный голубой осадок (рис. 1, в).
Карбонаты магния, кальция, стронция и бария образовывались в виде белых аморфных осадков:
MgSO4 + K2CO3 = MgCO3v + K2SO4
Mg2+ + CO32- = MgCO3v
Ca(NO3)2 + K2CO3 = CaCO3v + 2KNO3
Ca2+ + CO32- = CaCO3v
Sr(NO3)2 + K2CO3 = SrCO3v + 2KNO3
Sr2+ + CO32- = SrCO3v
Ba(NO3)2 + K2CO3 = BaCO3v + 2KNO3
Ba2+ + CO32- = BaCO3v
Взаимодействие полученных карбонатов с кислотой можно описать с помощью реакций:
NiCO3 + 2HCl = H2O + CO2^ + NiCl2,
NiCO3 + 2H+ = H2O + CO2^ + Ni2+;
CoCO3 + HCl = H2O + CO2^ + CoCl2,
CoCO3 + 2Н+ = H2O + CO2^ + Co2+;
CuCO3 + 2HCl = H2O + CO2^ + CuCl2,
CuCO3 + 2H+ = H2O + CO2^ + Cu2+;
MgCO3 + 2HCl = H2O + CO2^ + MgCl2,
MgCO3 + 2H+ = H2O + CO2^ + Mg2+;
CaCO3 + 2HCl = H2O + CO2^ + CaCl2,
CaCO3 + 2H+ = H2O + CO2^ + Ca2+;
SrCO3 + 2HCl = H2O + CO2^ + SrCl2,
SrCO3 + 2H+ = H2O + CO2^ + Sr2+;
BaCO3 + 2HCl = H2O + CO2^ + BaCl2,
BaCO3 + 2H+ = H2O + CO2^ + Ba2+.
При взаимодействии осадков осажденных карбонатов с раствором кислоты наблюдали растворение осадка и выделение газа. В качестве примера на рис. 2 представлен процесс взаимодействия карбоната кобальта (II) с раствором соляной кислоты. При этом цвет растворов принимал окраску исходных растворов солей d- или s-элементов.
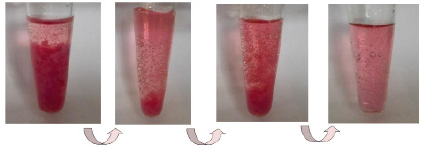
Рис. 2. Растворение осажденного карбоната кобальта (II) в соляной кислоте

Рис. 3. Растворение мела под действием соляной кислоты
Мел – естественный карбонат, если капнуть на него соляной кислотой, пойдет реакция растворения порошка с образованием бесцветного раствора и выделения CO2 (рис. 3). Данная реакция является лабораторным способом получения углекислого газа.
4) CaCO3 + 2HCl = H2O + CO2^ + CaCl2,
CaCO3 + 2H+ = H2O + CO2^ + Ca2+.
Выводы
Цвет осажденного карбоната зависит от окраски двухвалентной соли: у голубой соли меди (II) образуется голубой карбонат, у красно-фиолетовой соли кобальта (II) – малиновый, у зеленоватой соли никеля (II) – салатовый, а у бесцветных солей магния, кальция, стронция и бария карбонат получается белый.
При взаимодействии с сильной кислотой все карбонаты распадаются с выделением углекислого газа.
Библиографическая ссылка
Ульянова В.А. ПОЛУЧЕНИЕ И СВОЙСТВА КАРБОНАТОВ МЕТАЛЛОВ // Международный школьный научный вестник. 2018. № 6-1. ;URL: https://school-herald.ru/ru/article/view?id=812 (дата обращения: 10.02.2026).
