Проблема кормов относится к числу важнейших проблем морской аквакультуры. При выращивании водных животных в искусственных условиях используемые корма должны полностью удовлетворять потребности организма рыб или беспозвоночных в питательных веществах (белках, жирах и углеводах), минеральных солях, микроэлементах и витаминах. На разных этапах развития гидробионтов пища должна быть соответствующего размера и формы [3].
Особенно остро в аквариумистике стоит вопрос о кормлении мальков рыб и мелких беспозвоночных животных. Например, кораллы, у которых нет симбиотических водорослей зооксантелл, должны получать корм извне, а поскольку в аквариумах обычно развивается небольшое количество зоопланктона, то в отсутствие дополнительного корма они находятся в угнетенном состоянии (рис.1, А и Б). Для поддержания нормального, здорового состояния коралла, его нужно кормить искусственно минимум раз в неделю [1, 2].


Рис. 1. А) Голодная и очень слабая тубастрея в отсаднике на откорме. Б) Сильная сытая тубастрея на постоянном месте в аквариуме.
Еще одна проблема – это выращивание мальков, в частности их выкармливание. Важным этапом в жизни многих водных животных становится переход к самостоятельному питанию. Оказывается, что рыбы и ракообразные особенно требовательны к кормам именно на ранних этапах онтогенеза. Установлено, что для нормального развития и оптимального роста личинок и молоди культивируемых гидробионтов предпочтительны живые корма. В морской аквакультуре используются те кормовые организмы, которые можно выращивать в необходимом количестве в искусственных условиях [3].
Солоноватоводные коловратки – традиционный начальный живой корм для личинок морских рыб и беспозвоночных в условиях искусственного выращивания. По размерно-морфологическим характеристикам они подходят большинству личинок морских организмов в качестве стартового живого кормового организма при переходе на внешнее питание (Рис. 2) [11, 13, 15].
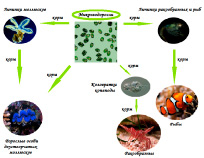
Рис. 2. Использование микроводорослей в аквакультуре
С точки зрения затрат эффективное культивирование коловраток опирается на дешевые питательные источники, поэтому пекарские дрожжи были и остаются основным компонентом питательных эмульсий для их кормления. Однако хорошо известно, что на дрожжевом рационе коловратки испытывают недостаток незаменимых жирных кислот, необходимых для высоких показателей роста рыб и беспозвоночных [6]. Но многие исследователи считают, что культивирование коловраток как корма для морских гидробионтов необходимо проводить на одноклеточных микроводорослях. Одноклеточные водоросли удовлетворяют требованиям массового культивирования коловраток по множественным параметрам. В отличие от дрожжей они: 1) более питательны, и коловратки, питающиеся ими, соответствуют по биохимическому составу потребностям личинкам морских рыб для нормального роста и развития (табл. 1); 2) находятся в толще воды в подвижном состоянии, а не оседают на дно, как дрожжи; 3) в связи с этим, в отличие от последних, не создают благоприятные условия для развития простейших, весьма нежелательных при массовом культивировании коловраток, ибо их токсины отрицательно воздействуют на рост культуры, а сами они являются пищевыми конкурентами коловраток и создают дефицит кислорода; 4) улучшают гидрохимический фон среды, включая в свой метаболизм отходы жизнедеятельности организмов в форме как неорганических, так и органических соединений [15].
Таблица 1
Максимальное содержание (% от сухого веса) белка, углеводов, липидов в кормовых микроводорослях и их суммарная калорийность (ккал/г СВ)
|
Вид водорослей |
Белок |
Углеводы |
Липиды |
Суммарная калорийность |
|
Phaeodactylum tricornutum [15] |
40,7 |
20,8 |
20,0 |
4,77 |
|
Tetraselmis suecica [15] |
40,35 |
21,32 |
27,0 |
4,17 |
|
Isochrysis galbana [15] |
49,8 |
28,4 |
25,6 |
6,24 |
|
Chlorella sp. [7] |
40–55 |
35 |
5–10 |
4,15 |
В Севастопольском морском Аквариуме-музее огромное количество гидробионтов, содержащихся в искусственных экосистемах. Это не только рыбы, но и многие представители беспозвоночных. В связи с необходимостью обеспечения их качественным живым кормом, возникла необходимость освоения методов культивирования морского зоопланктона, в частности, солоноватоводной коловратки Brachionus plicatilis.
Поэтому, целью данной научно-исследовательской работы было получение количественных характеристик процесса выращивания коловраток Brachionus plicatilis на микроводорослях разных таксономических групп, рекомендуемых для этих целей: Isochrysis galbana, Chlorella sp., Phaeodactylum tricornutum и Tetraselmis suecica [4, 12, 13]. Для достижения поставленной цели следовало решить ряд задач:
1. Ознакомиться с литературой по теме исследования;
2. Изучить теоретические основы культивирования микроводорослей и коловраток;
3. Подготовить посуду и необходимое оборудование;
4. Освоить микроскопию с использованием микроскопов БИОЛАМ и МБС с различным увеличением;
5. Приготовить среду Уолна для культивирования микроводорослей;
6. Освоить методы подсчета микроводорослей (в камере Горяева) и коловраток (в камере Богорова);
7. Произвести посев микроводорослей в подготовленную среду;
8. Вести ежедневный подсчет количества клеток водорослей в накопительной культуре;
9. Произвести высев культуры коловраток в емкости с накопительными культурами микроводорослей;
10. Вести ежедневный количественный учет клеток водорослей и коловраток;
11. Свести все полученные данные в таблицы, произвести необходимые расчеты, построить графики;
12. Рассчитать стоимость проекта по получению живых кормов;
13. Сделать выводы.
Материалы и методы
В качестве пищевых объектов в экспериментальных исследованиях коловраток были использованы следующие микроводоросли (табл. 2) [11].
Источником моновидовых накопительных культур этих микроводорослей служили линии микроводорослей, выращенные группой культивирования рыб отдела аквакультуры и морской фармакологии ИМБИ РАН, исходно полученные из музея-коллекции живых культур морских микроводорослей ИМБИ РАН (ранее ИнБЮМ).
Isochrysis galbana – золотистая микроводоросль. Клетки сферические подвижные, с двумя равными жгутиками [16].
Tetraselmis suecica – зеленая микроводоросль. Клетки зеленые, овальные. Клетки подвижные с 4 жгутиками длиной 7,5 мкм. Имеют мягкую оболочку. Обладают высокой скоростью размножения, до 4 делений в сутки [16].
Рhaeodactylum tricornutum – одноклеточные диатомовые водоросли [17].
Chlorella sp.- микроскопическая зеленая водоросль [8].
Таблица 2
Размерные характеристики и объемы клеток микроводорослей
|
Вид микроводорослей |
Длина клетки (мкм) |
Объем клетки (мкм3) |
Класс |
|
Isochrysis galbana |
3 – 5 |
39,19 |
Prymnesiophyceae |
|
Chlorella sp. |
2 – 4 |
14,14 |
Trebouxiophyceae |
|
Phaeodactylum tricornutum |
4 – 5 |
113,0 |
Bacillariophyceae |
|
Tetraselmis suecica |
7 – 14 |
505,3 |
Prasinophyceae |
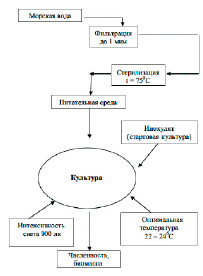
Рис. 2. Схема подготовки питательной среды и массового культивирования микроводорослей
Использованные в экспериментах микроводоросли выращивали в накопительном режиме на основе стерилизованной черноморской воды обогащенной средой Уолна [9], при температуре 23 ± 1.5 С. Круглосуточное освещение интенсивностью 900 lux осуществляли с помощью люминесцентных ламп для растений FLUORA L18W/77 (рис. 2).
Brachionus plicatilis Muller – солоноватоводная (диапазон солености 9-32‰) планктонная коловратка со слабовыраженной пищевой избирательностью, предпочитающая клетки 1-15 µм в диаметре, питающаяся бактериями, дрожжами, одноклеточными водорослями [15].
Малые размеры, невысокая подвижность и толерантность к аутоингибированию при высоких плотностях определяют их технологичность при выращивании в массовых культурах. При искусственном культивировании используют обычно партеногенетические клоны коловраток Brachionus plicatilis, которые состоят из диплоидных самок, воспроизводящих себе подобных, полностью идентичных дочерних особей с диплоидным набором хромосом. Эти клоны очень технологичны в эксплуатации, так как их продукционные показатели значительно выше циклично партеногенетических культур коловраток [11].
Культура коловраток Brachionus plicatilis была добавлена в культуры микроводорослей, находящихся в стадии экспоненциального роста, которые считаются более качественным кормом.
Партеногенетическая культура коловраток Brachionus plicatilis Mulleri – из коллекции живых культур планктона группы культивирования рыб отдела аквакультуры и морской фармакологии ИМБИ РАН.
Определение плотности (численности) клеток водорослей методом прямого подсчета в камере Горяева [10]. Содержимое колбы с водорослями перемешивали вручную, затем пипеткой отбирали суспензию водорослей (аликвоту) и наносили по одной капле на верхнюю и нижнюю части сетки счетной камеры Горяева. Затем камеру накрывали покровным стеклом, которое притирали по бокам до появления колец интерференции. Капли суспензии водорослей наносили не подряд из одной пипетки, а при двукратном взятии суспензии в пипетку из одной и той же колбы.
Через 1-2 мин после оседания клеток водорослей камеру Горяева помещали под объектив бинокулярного микроскопа БИОЛАМ ЛОМО с фазовым контрастом КФ-4 и подсчитывали количество клеток водорослей во всех 25 больших квадратах сетки.
Плотность (численность) клеток водорослей в 1 см суспензии водорослей рассчитывали по формуле:
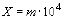 ,
,
где m – суммарное количество клеток водорослей в учтенных больших квадратах сетки;
104 – коэффициент пересчета кубических миллиметров в кубические сантиметры.
Плотность (численность) клеток водорослей подсчитывают в каждой колбе, отбирая по две аликвоты.
Биомасса водорослей. Принимая удельный вес клетки пресноводных и солоноватоводных видов равным единице, биомассу водорослей вычисляли по формуле [5]:
Wкл.=Vкл.·ρ (мкг/мл),
где Wкл. – биомасса, Vкл. – объем клетки, ρ – удельный вес
Численность коловраток Brachionus plicatilis определяли прямым подсчетом в камере Богорова [14].
Удельную скорость роста (μср.) за определенный промежуток времени определяли по формуле:
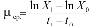 (сут-1),
(сут-1),
где X1 и X0 – биомасса организмов соответственно в начале и конце роста;
t1 – t0 – время роста [4, 5].
Обсуждение полученных результатов
Наиболее энергосберегающий способ культивирования – накопительный – широко применяется в марикультуре из-за простоты и гибкости в обращении [11].
В первый день эксперимента была произведена инокуляция клеток 4 культур микроводорослей Phaeodactylum tricornutum, Tetraselmis suecica, Isochrysis galbana и Chlorella sp. в емкости, содержащие стерильную морскую воду и питательную среду. Далее, мы наблюдали рост культур и просчитывали численность микроводорослей (рис. 3).
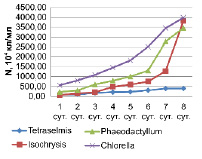
Рис. 3. Динамика численности микроводорослей в накопительных культурах
Из рисунка видно, что за время эксперимента максимальных значений численности достигли Chlorella sp. и Isochrysis galbana – 39,85 • 106 кл/мл и 38,18 × 106 кл/мл.
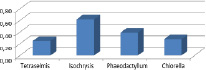
Рис. 4. Средняя удельная скорость роста микроводорослей за время эксперимента, сут-1
Максимальная удельная скорость роста клеток была отмечена в накопительной культуре микроводоросли Isochrysis galbana и составила 0,62 сут-1 (рис. 4).
При достижении культурами достаточно высоких концентраций – на 8 сутки эксперимента – в емкости с микроводорослями была добавлена культура коловраток Brachionus plicatilis. Эксперимент был продолжен до тех пор, пока количество клеток водорослей в экспериментальных емкостях не снизилось до минимальных значений.
На рисунке 5 представлена динамика численности коловраток и изменение количества клеток водорослей, а на рисунке 6 – только динамика численности коловраток на различных культурах микроводорослей. Из графиков видно, что количество Brachionus plicatilis на всех культурах водорослей достигали практически одинаковых значений – 350-380 кол/мл.
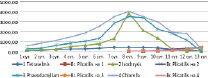
Рис. 5. Изменение численности микроводорослей (104 кл/мл) и коловраток (кол/мл)
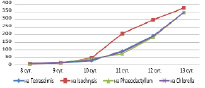
Рис. 6. Динамика численности Br. plicatilis на микроводорослях, кол/мл
Средняя удельная скорость роста численности коловраток была максимальна в емкостях с культурой Isochrysis galbana – 1.035 сут-1 (рис. 7).
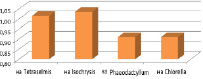
Рис. 7. Удельная скорость роста коловраток на микроводорослях (сут-1)
Расчет затрат на реализацию проекта
Запущенный процесс бесперебойного культивирования коловраток на культуре водоросли Isochrysis galbana (объем культуры был увеличен до 10 л), позволил с успехом кормить всех беспозвоночных и молодь рыб, содержащихся в Севастопольском Аквариуме-музее (рис. 8, 9).

Рис. 8. Этапы получения культуры коловраток Br. plicatilis на микроводорослях
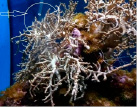
Рис. 9. Кормление беспозвоночных коловратками в Аквариуме
Таблица 3
Стоимость реактивов для приготовления среды Уолна (на 104 л стерильной морской воды)
|
№ |
Реактив |
Цена за кг, руб. |
Потребность, г |
Стоимость, руб. |
|
1 |
NaNO3 |
120.00 |
1000 |
120.00 |
|
2 |
NaH2PO4•2H2o |
140.00 |
200 |
28.00 |
|
3 |
H3BO3 |
80.00 |
346 |
27.68 |
|
4 |
MnCl2 |
100.00 |
3.6 |
0.36 |
|
5 |
ТРИЛОН Б (ЭДТА) |
230.00 |
450 |
103.50 |
|
6 |
FeCl3•6H2O |
65.00 |
13 |
0.85 |
|
7 |
CuSO4 |
150.00 |
200 |
30.00 |
|
8 |
CoCl2•6H2O |
750.00 |
20 |
15.00 |
|
9 |
(NH4)6•MoO2•4H2O |
1700.00 |
90 |
153.00 |
|
10 |
Витамин B1 |
1689/500мг |
0.003 |
5.00 |
|
11 |
Витамин B12 |
980/1000мкг |
0.0006 |
1.00 |
|
ИТОГО |
484.40 |
|||
Расход на 10 л среды/неделю – 0.50 руб.
Таблица 4
Стоимость расходных материалов
|
№ |
Расходный материал |
Цена, руб. |
Потребность в год |
Стоимость, руб. |
|
1 |
Фильтр мембранный ФМАЦ-0,45, 90 мм, размер пор 0,45 мкм |
2 400/50 шт. |
50 шт. |
2 400 |
|
2 |
П/э пакеты 60 × 80, толщина 90 мкм |
1 620/100 шт. |
100 шт. |
1 620 |
|
3 |
Лампа люминесцентная OSRAM FLUORA L 18W/77 |
585 |
4 шт. |
2 340 |
|
4 |
Спирт медицинский, 96% |
300 |
1 л |
300 |
|
5 |
Электроэнергия |
3,40 за кВт.ч |
643кВт.ч |
2 185 |
|
ИТОГО |
8 785 |
|||
Чтобы обеспечить прирост биомассы микроводорослей и бесперебойное получение живого корма для гидробионтов Аквариума был составлен перечень необходимого оборудования и расходных материалов (табл. 3 и 4).
Всего затрат – 8 810 руб./год
Заключение
Таким образом, в результате исследования получены следующие результаты:
1. Для культивирования микроводорослей нами был использован накопительный режим, который позволил в течение 8 суток получить высокие численности микроводорослей: начальная концентрация водорослей составляла 74 • 104, 61,75 • 104, 225,8× 104, 560 • 104 кл/мл для микроводорослей Tetraselmis suecica, Isochrysis galbana, Phaeodactylum tricornutum и Chlorella sp. соответственно. В процессе роста микроводорослей произошло увеличение концентрации клеток до следующей плотности, соответственно 395,83 • 104, 3818,33 • 104, 3466,67 • 104, 3985 • 104 кл/мл для Tetraselmis suecica, Isochrysis galbana, Phaeodactylum tricornutum и Chlorella sp. Биомасса Tetraselmis suecica увеличилась с 0,037 мг/мл до 0,2 мг/мл, Isochrysis galbana – с 0,002 до 0,149 мг/мл, Phaeodactylum tricornutum – с 0,026 до 0,392 мг/мл, Chlorella sp. – с 0,008 до 0,056 мг/л. То есть, все 4 культуры микроводорослей Isochrysis galbana, Chlorella sp., Phaeodactylum tricornutum и Tetraselmis suecica могут быть использованы для получения накопительных культур высокой плотности.
2. Максимальную удельную скорость роста показала культура микроводоросли Isochrysis galbana – 0,62 сут-1.
3. На 8 сутки эксперимента в емкости с культурами микроводорослей были добавлены коловратки Brachionus plicatilis в следующих количествах: 6 кол/мл к водорослям Tetraselmis suecica и sochrysis galbana, 9 кол/мл – к водорослям Phaeodactylum tricornutum и Chlorella. В конце эксперимента, на 13 сутки, количество коловраток увеличилось до следующих значений: 350 кол/мл в емкостях с водорослями Tetraselmis suecica, Isochrysis galbana и Chlorella sp, 380 кол/мл – с Phaeodactylum tricornutum. Таким образом, все культуры микроводорослей могут быть использованы практически с равным успехом для выращивания коловраток Brachionus plicatilis и получения живого корма для кормления гидробионтов, содержащихся в искусственных экосистемах Севастопольского морского Аквариума-музея.
4. Максимальное значение удельной скорости роста коловраток было получено для микроводоросли Isochrysis galbana и составило 1,035 сут-1. Таким образом, эта микроводоросль наиболее предпочтительна для получения полноценного живого корма с наименьшими временными затратами.
5. Расчет проекта и его успешная апробация по получению коловраток в лаборатории Севастопольского морского Аквариума-музея показали, что расход денежных средств составит около 9 000 руб./год.
Библиографическая ссылка
Кваша А.В. ВЫРАЩИВАНИЕ КОЛОВРАТОК BRACHIONUS PLICATILIS НА МИКРОВОДОРОСЛЯХ РАЗНЫХ ТАКСОНОМИЧЕСКИХ ГРУПП // Международный школьный научный вестник. 2018. № 4-3. ;URL: https://school-herald.ru/ru/article/view?id=601 (дата обращения: 26.02.2026).
