Актуальность. В последнее время многие водоемы Тульской области относятся к категории загрязненных мест. В основном это связано с выхлопными выбросами транспортных средств, химических веществ от производств, а также острой проблемой остается следовое влияние Чернобыльского загрязнения. Поэтому возникает потребность в очистке воды от химических веществ посредством установки очистных фильтров, либо использование определенной родниковой воды, которая содержит полезные макро- и микроэлементы, однако использование такой воды сомнительно по причине того, что родниковые воды являются также открытыми водоемами, на которые могут влиять последствия человеческой деятельности [3: 4-5].
Проблема исследования. Следовательно, возникает вопрос, какую именно воду использовать в бытовых условиях человеку? Однозначный ответ на данный вопрос отсутствует, однако химики активно борются с загрязнителями как питьевой, так и воды для бытового применения. Используются различные химические методики на определение качества воды, разрабатываются эффективные очистные сооружения, которые улучшат качество воды в различных водных источниках.
Цель работы. Определить качество воды (органолептический и физико-химический показатели) из различных водных источников п. Рассвет Тульской области.
Задачи работы.
1. Проанализировать научную литературу о качестве воды и экологическом мониторинге водоемов.
2. Ознакомиться с правилами отбора проб воды и изучить методики оценки качества вод.
3. Сравнить качество воды из различных водных источников по органолептическим и физико-химическим показателям.
Предмет исследования. Процесс экологического влияния на качество воды из различных водных источников п. Рассвет Тульской области.
Гипотеза исследования. Исследование по органолептическим и физико-химическим свойствам проб воды из различных водных источников покажет наиболее приемлемое использование того водного источника, проба воды которого соответствует СанПиН 2.1.4.1074-01 Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения.
Методы исследования.
1. Теоретические (поиск и изучение научной литературы о качестве воды).
2. Экспериментальные (отбор проб воды, химический эксперимент).
3. Математические (обработка результатов исследования, выводы).
Основная часть
Вода является распространенным соединением, которое не бывает абсолютно чистым. Природная вода содержит многочисленные растворенные вещества, которые влияют на качество воды (соли, кислоты, газы, органические вещества, нерастворимые минеральные частица и т.д.).
В основном вкусовые свойства и качество воды зависят от состава и концентрации содержащихся в ней веществ. Также высокое содержание отходов антропогенного воздействия в воде неблагоприятно влияет на организм человека. Для загрязненной воды характерно высокое содержание сульфат-анионов, нитрат-анионов, катионов свинца, железа (II), меди (II) и др., которые пагубно воздействуют на здоровье человека.
Повышенная жесткость воды негативно сказывается на здоровье человека при умывании. Соли жесткости взаимодействуют с моющими веществами и образуют нерастворимые шлаки. Эти шлаки высыхают и остаются в виде микроскопической корки на кожном и волосяном покрове человека. Разрушается естественная жировая пленка кожного и волосяного покрова человека, забиваются поры, появляется сухость, шелушение, перхоть.
Чистая вода является для организма универсальным растворителем, которая способствует протеканию различных биологических процессов, и чтобы воздействие было благоприятным, необходимым условием является правильно выбранная воды, которая содержит полезные макро- и микроэлементы и отсутствуют загрязняющие химические вещества [1: 187].
Методика определения ионов в пробах воды
1. Определение сульфат ионов SO42-.
К 5 мл проб воды добавить 4 капли 10% раствора соляной кислоты HCl и 4 капли 5% раствора хлорида бария BaCl2. Должен образоваться осадок или муть: Ba2+ + SO42- = BaSO4
• слабая муть – 1-10 мг/л,
• сильная муть – 10-50 мг/л,
• хлопья – 50-100 мг/л,
• белый творожистый осадок > 100 мг/л.
2. Определение ионов хлора Cl- .
К 5 мл проб воды добавить 3 капли 10% раствора нитрата серебра AgNO3, подкисленного азотной кислотой HNO3. Образуется осадок или муть: Ag+ + Cl- = AgCl
• слабая муть – 1-10 мг/л,
• сильная муть – 10-50 мг/л,
• хлопья – 50-100 мг/л,
• белый творожистый осадок > 100 мг/л.
3. Определение ионов железа Fe3+.
К 10 мл исследуемого проб воды прибавляют 1-2 капли соляной кислоты HCl, несколько капель пероксида водорода и 0,2 мл (4 капли) 50%-го раствора тиоцианата калия KSCN. Перемешивают и наблюдают за развитием окраски.
Качественная реакция протекает по ионному уравнению: Fe3+ + 3SCN- = Fe(SCN)3.
4. Определение ионов свинца Pb2+.
Иодид калия (KI) дает в растворе с ионами свинца характерный осадок йодида свинца PbI2. К 5 мл испытуемого раствора прибавить немного KI, после чего, добавив уксусной кислоты CH3COOH, нагреть содержимое пробирки до полного растворения первоначально выпавшего, мало характерного желтого осадка PbI2. Охладить полученный раствор под краном, при этом PbI2 выпадет снова, но уже в виде красивых золотистых кристаллов: Pb2+ +2I- = PbI2 [1: 211-226. 2].
Методика определения жесткости воды
1. Определение общей жесткости воды мыльным раствором.
В пронумерованные пробирки наливают три образца воды по 10-15 мл. В каждую пробирку кидают кусочек мыла и сильно встряхивают пробирку (около 5 минут). Дают отстояться и описывают внешний вид полученных растворов: есть ли осадок в виде хлопьев, много осадков или мало, раствор почти прозрачный и т.д.
2. Определение гидрокарбонатной жесткости воды
Мерной колбой отобрать 100 мл исследуемой воды, перенести в коническую колбу для титрования. Добавить 3-4 капли метилового оранжевого и титровать раствором HCl (в бюретке) до перехода окраски из желтой в оранжевую. Титрование проводят 3 раза до получения сходящихся результатов (отличающихся на 0,1 мл). Вычислить средний объем соляной кислоты Vсред(HCl). Рассчитать гидрокарбонатную жесткость воды в моль/л.
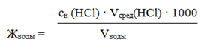
Результаты и обсуждения
Исследования проводились в начале апреля 2018 года на трех участках: открытый водоем п. Рассвет Тульской области, когда снег растаял (проба №1); вторым участком явился жилой дом с централизованным водоснабжением, откуда была взята проба (проба №2) и последний участок – родниковая вода п. Рассвет (проба №3).
Анализируемые пробы воды исследовали на органолептические и физико-химические свойства (определение сульфат-анионов, хлорид-анионов, катионов железа (III), свинца (II), жесткость воды).
Исследования на органолептические свойства (по цветности, запаху, рН) приведены в табл. 1.
Таблица 1
Органолептические показатели
|
Показатели |
Проба №1 |
Проба №2 |
Проба №3 |
|
По цвету |
Мутноватая |
Прозрачная с частицами |
Прозрачная |
|
По запаху |
Отсутствует |
Запах хлора |
Отсутствует |
|
pH |
6 |
7 |
7 |
Физико-химические исследования проводились на определение ионов, которые входят в состав химических веществ, относящихся к загрязняющими воду, также проведены реакции на содержание в пробах воды гидрокарбонатной жесткости.
Проба №1 «Речная вода» имеет мутноватый цвет раствора, запах отсутствует, рН около 6, что соответствует норме. Исследования на определение ионов SO42- – слабая муть – 1-10 мг/л. Реакция на определение ионов Cl- – слабая муть – 1-10 мг/л. Ионов Fe3+ и Pb2+ не наблюдается, что связано с малым содержанием, которое невозможно определить качественными реакциями.
Проба №2 «Техническая вода» имеет прозрачный цвет с мелкими частицами, запах хлора отчасти присутствует, рН = 7, соответствует стандартам. Исследования на определение ионов SO42- имеют слабую муть, расчеты колеблются в диапазоне 1-10 мг/л. Реакция на определение ионов Cl- – слабая муть – 1-10 мг/л. Ионов Fe3+ содержатся в микроколичествах, имеет розоватый цвет раствор, Pb2+ не наблюдается, что связано с малым содержанием, которое невозможно определить качественными реакциями.
Проба №3 «Родниковая вода» имеет прозрачный цвет, запах отсутствует, рН = 7. Исследования на определение ионов SO42- имеют слабую муть, колеблются в диапазоне 1-10 мг/л. Реакция на определение ионов Cl-, Fe3+ и Pb2+ не наблюдается (рис. 1,2,3,4).
Таким образом, требованиями стандартов по качеству воды соответствует только родниковая вода [4].

Рис. 1. Реакция на определение ионов SO42

Рис. 2. Реакция на определение ионов Cl

Рис. 3. Реакция на определение ионов Fe3+

Рис. 4. Реакция на определение ионов Pb2+
По второму направлению было проведено определение жесткости воды. Результаты занесены в табл. 2.
Таблица 2
Результаты исследования жесткости воды мыльным раствором
|
Образцы воды |
Характеристики внешнего вида |
|
Проба №1 |
Раствор мутный, осадок в виде хлопьев |
|
Проба №2 |
Раствор мутный, мало осадка |
|
Проба №3 |
Раствор мутный, мало осадка |
Определение жесткости мыльным раствором показало, что наибольшее количество мыльного раствора и осадка образовалось в пробе №1 «Речная вода» свидетельствует об их наибольшей жесткости (рис. 5).

Рис. 5. Определение общей жесткости воды мыльным раствором
Определение гидрокарбонатной жесткости производилось раствором соляной кислоты. Результаты определения гидрокарбонатной жесткости (табл. 3) позволяют сделать вывод, что наибольший объем соляной кислоты требуется для титрования речной воды, наименьший – для родниковой воды.
Таблица 3
Результаты определения гидрокарбонатной жесткости
|
Пробы воды |
Объем исследуемого образца воды (мл) |
Средний объем раствора соляной кислоты (мл) |
Показатель жесткости воды |
|
речная |
50 |
0,9 |
18 |
|
техническая |
50 |
0,3 |
6,0 |
|
родниковая |
50 |
0,2 |
4,0 |
Вычислив по расчетной формуле жесткость воды, и сравнив показатели с данными значениями общей жесткости (табл. 4), определили тип образцов воды: техническая и родниковая пробы вод являются средней жесткости, речная вода – жесткой.
Таблица 4
Типы природной воды по значению общей жесткости
|
Тип воды |
Жесткость, ммоль/л |
|
Очень мягкая |
Меньше 1,5 |
|
Мягкая |
1,5-4 |
|
Средней жесткости |
4-8 |
|
Жесткая |
8-12 |
|
Очень жесткая |
12 |
Заключение
После проведения исследовательской работы и обсуждения полученных результатов мы пришли к следующим выводам:
1. Проанализирована научная литература о качестве воды и экологическом мониторинге.
2. Исследованы методики на органолептические и физико-химические свойства воды.
3. Сделаны выводы о качестве выбранных проб вод. Качественной водой, соответствующей нормам СанПина является только родниковая вода, техническая вода относительно пригодна, речная вода имеет загрязнение.
Библиографическая ссылка
Фомин Г.А. ИССЛЕДОВАНИЕ КАЧЕСТВА ВОДЫ ИЗ ВОДНЫХ ИСТОЧНИКОВ ТУЛЬСКОЙ ОБЛАСТИ П. РАССВЕТ // Международный школьный научный вестник. 2018. № 4-3. ;URL: https://school-herald.ru/ru/article/view?id=622 (дата обращения: 04.03.2026).
